基本粒子物理与药物酞胺哌啶酮所引起的胎儿畸形事件有什么关系呢?在制酒工业,晶体形状,合成化学和理论物理学等方面都已经发现了这种关联的线索,所有这些都与自然界的左手性有关。
在五十年代后期,美国物理学家发现在某些基本粒子相互作用过程中,镜像对称(宇称)并不保持。在六十年代,许多怀孕妇女由于服用药物酞胺哌啶酮(thalidomide)生下畸形儿。初看起来,这两件事似乎不相关。但是这两件事有它们的根源,对此现在每个化学家和生物化学家都已经知道了:生物有机的本质是单手性的。因此,更完善地运用化学家的艺术,生产具有特定手性的药物,药物工业可能避免酞胺哌啶酮这一类悲惨事件。
许多有机分子以左手性和右手性的形式存在。这个性质称作手征性,是一个碳原子的四个价键本身在空间不同排列的结果。这些价键指向一个四面体的四个顶点。如果键合碳原子的四个原子团是各不相同的,则有两种可能的排列。一种构形是另一种构形的镜像,就像左手和右手的关系一样。
当一种手性物质在实验室中被合成的时候,通常产生等量右手的(D,dextro)和左手的(L,laevo)分子的混合物,但是活生物体总是主要合成一种特定手性的分子。实际上所有蛋白质都是由L氨基酸组成的,例如,产生蛋白质的细胞组织本身就是由L氨基酸和D糖组成的。而相应的镜像形式,特别是D氨基酸,仅能在一些原始的生物组织例如细菌的细胞壁中找到。经过进化,某些真菌的细胞组织会产生抗菌素,例如青霉素,它包含D氨基酸并有阻止细菌的细胞壁构成的功能。但是生物有机体的手征性的起源是什么呢?为什么生物化学过程特别选取L氨基酸和D糖,而不是它们的镜像形式?为了回答这些问题,我们必须从路易 · 巴斯德在十九世纪中期的研究说起。
巴斯德对于从酒石(陈酒的沉积物)中离析出来的两种物质具有不同的晶体形式和光学活性感到迷惑不解。当偏振光穿透主要成分(+)酒石酸的溶液时、光的偏振面按顺时针方向旋转,即以正右手性方向旋转(因此以(+)作为标记)。而次要成分,外消,旋酒石酸(racemic acid),虽然在化学上是同一物质,但对偏振光并无光学活性。巴斯德注意到外消旋酒石酸钠铵盐形成两类不同的晶体,而不是以前所说的只有一类,他人工地将它们分开了。每类晶体的不同仅在于它们的小面相对位置的排列方式。这些晶体的小面的两种排列之间互呈镜像关系,就像右手和左手的关系一样。巴斯德发现其中一类晶体的小面构形等同于(+)酒石酸钠铵盐晶体的小面构形。当它们溶于水时,两者都使偏振光平面向右旋转。第二类晶体,其构形是前一类的镜像,是(-)酒石酸钠铵盐,其溶液使偏振光平面反时针方向旋转,即按相反的左手方向旋转。因此,巴斯德推断那种没有光学活性的外消旋酒石酸是等量的(+)和(-)酒石酸的混合物。后来,任何没有光学活性的手性混合物一概被叫做“外消旋的”(racemic)。
在整个十九世纪,许多法国化学家认为一个晶体和它的每个分子结构单元在整个构形上是“互相酷似”的。所以巴斯德得出结论:因为(+)和(-)酒石酸盐在结晶形式上是互相镜像的,所以也都是分子结构的构成单位。他创造了“dissymétrie”(不对称)这个词来描述一种分子的或宏观的手性结构。通常这个名词被不准确地转变为“asymmetric”,后来又被“chiral”(手性,希腊字cheir)所代替。巴斯德推测手性分子和互成镜像的晶体是由于宇宙中无所不在的不对称的力产生的。根据迈克尔 · 法拉第(Michael Faraday)的发现——在通常条件下非光学活性的玻璃棒被置于磁场内时将显示出光学活性,巴斯德认为经典极性场(电、磁,重力和旋转场)基本上是不对称的。但他在这些场中关于化学反应,晶体和植物生长方面的试验是完全无结果的。过了三十年,在他的卓著的微生物学发现之后,他报告了否定的结果,但仍然重申他的信念,认为不对称的力作用于整个物理和有机世界。
事实上,手性力场可以结合两个极性场构造出来。在运用左的或右的圆偏振光(就是具有顺时针方向或反时针方向自旋的光子)所作的光化学反应中,外消旋混合物的手性对称遭到破坏。外消旋混合物中两种旋光异构体之一,将有选择的吸收一类顺时针自旋的光子,并从这特定的同分异构体中产生一种光化产品,而另一种对映异构体保持不变。但是这个过程并不能解释蛋白质中的L氨基酸,和在DNA和细胞壁中并作为活生物体中的能源的D糖的特殊选择。经典极性场所有的自然混合结果都是双手性的。例如,在黎明,初升的太阳的光斜射大气层和散射在灰尘和烟雾上之后,大约有0.1%被圆偏振。但是在黄昏,下落的太阳的光以同样程度向相反的方向圆偏振。巴斯德所说的自然界不对称性的根源我们必须到别处寻找。
然而,化学动力学能够解释为什么活生物体采用了单手性生物化学形式,而没有采用相应的外消旋混合物。一般说来,纯物质的化学反应比起相应的混合物的反应更为有效。例如,一种典型的纯L或纯D氨基酸衍生物聚合成多肽的速度将要比1:1的外消旋混合物在同样条件下快大约20倍。这样产生的多肽是螺旋形的——对于L氨基酸是有旋的,如果采用D氨基酸则产生左旋的。这种多肽选择纳入现有手性结构的适当的结构单元,促进其扩展。
不是机会问题
现在假定我们要聚合一种氨基酸结构单元(单体)的外消旋混合物,但是在反应中“播”下其中一方(例如L氨基酸)的微弱多数。则出现在所合成的多肽中(在反应刚完成的时候)L氨基酸衍生物的比例要高于在原先非聚合的混合物中播下的比例。这种优势扩展的原因如前所述,是由于同类旋光异构体之间的反应比起互成镜像的分子之间的反应效率更高的缘故。在另一种过程,即通常的生物学过程中,多肽部分地被分裂成单体,这种手性优势的扩展还要显著。(动物消化食物的方式是分裂蛋白质——多肽——为氨基酸,然后重新聚合成它自己的蛋白质)。手性螺旋形聚合物的分裂优先发生在它从右旋到左旋的转折点上。以这些方式,自动复制系统从一种以异手性化学作为基础的新陈代谢转变为这个更有效的活生物体的同手性生物化学现象。这个过程可能已发生了几十亿年一也可能是一个很短暂的时期,是将突变理论应用于化学反应的竞争序列上得出这一结论的。不管是哪一种情形,开始都需要有一种旋光异构体的微弱数量优势或某些其他手性偏向。否则这样一个同手性结果,特定以L氨基酸和D糖为基础的生物化学现象,仅仅是一个机会的问题了。
现在证实了巴斯德关于宇宙中不对称的力的信念是很有道理的,但是这种力存在于他那时代所不知道的领域:基本粒子领域中。强相互作用,如同经典电磁场和重力场一样是双手性的,但是弱相互作用则有手性偏向。弱相互作用引起放射性元素和一些亚核粒子的衰变。在这些衰变中出现的反常现象导致美籍中国物理学家李振道和杨振宁(他们获得1957年诺贝尔奖金)得出结论:在弱相互作用中宇称(镜像对称)并不守恒。例如在放射性钴60的β衰变中放出的电子主要是左旋的,而在钴58的相应衰变中放出的正电子主要是右旋的(这里的旋向是参照粒子的自旋的取向和它的运动方向的关系:当为正电子时平行,电子时反平行)。这种“反常”衰变的发现引起科学家们推测:如果将β放射性物质加进外消旋反应混合物中,其中一种旋光异构体将比另一种反应得快。但是至今还未能观测到这个预期的效应。
物理学家原先研究的弱相互作用涉及电荷的变化,例如中性的中子衰变为带正电的质子和带负电的电子。这类作用由弱电流所支配,以巨大的带电荷的玻色子W±为中介。但是弱电流对于并无电荷变化的原子和分子的性质是不大重要的。一项主要进展是由S. 格拉肖,A. 萨拉姆和S. 温伯格(他们因此获得1979年的诺贝尔奖金)取得的,他们将电磁和弱相互作用统一起来。他们的理论有效地将弱相互作用宇称不守恒(并因此不对称)的行为归并到支配化学键合的电磁相互作用中。
统一的电弱力的弱中性流(WNC)需要一种新粒子,即巨大的中性玻色子Z°,不久前已由欧洲核子研究中心找到了。因为弱中性流并不改变电荷,它对于原子和分子的静态性质有以下效应:特别是,预期它将引起所有原子和非手性分子具有微弱的光学活性,并能旋转偏振光平面。物理学家曾用铋原子的蒸汽证实了这个效应。而且,一个旋光异构体和它的镜像对映异构体将有稍微不同的电子键合能。那是由于弱中性流,手性分子的两种异构体在化学上是不完全等同的。
电子和它的反粒子即正电子在广义上互成镜像,即在通常的空间镜像之外还要加上电荷的更迭。同样,一个地球上存在的由粒子组成的右手性分子,在遥远的反物质世界里将有一个由反粒子以同样方式组成的完全镜像的左手性同分异构体。在地球上由反物质组成的分子不能存在,并且由通常物质组成的现有的左手性同分异构体和它的右手性镜像分子并不精确地具有相同的键合能和其他性质。计算表明,由自然出现的L氨基酸组成的多肽比起相应的D氨基酸聚合物更为稳定。在常温的水溶液中,一种氨基酸(L丙氨酸)要比D丙氨酸要稳定大约6×1014焦耳/摩尔。这个能量上的差异虽然很微小,相当于比在1摩尔另一种1:1的外消旋D/L混合物中多出大约一百万个L丙氨酸分子。结果表明这个能量差异足够促成生命发生之前外消旋混合物中的异手性化学现象,向着保证L多肽永远的优势方向发展。
为什么地球上的生命选择了以L氨基酸和D糖为基础的生物化学形式?对于这个问题的研究至今仍处于早期阶段。这个问题是跨学科的,无疑将有生物化学家、生物物理学家和化学物理学家等来发展它。同时,沿着化学的主要传统,研究者将继续寻求新物质和更有效的合成已知物质的方法。最近几年,这种探求使得药物工业和相关的工业有可能得到重大的发展和成功。
合成药剂的生产是从有机染料制造的基础上发展起来的。最初是由于保罗 · 埃尔利希(Paul Ehrlish)发现某些合成染料浸染生物制品是有选择的,特别是,一种墨水颜料亚甲蓝(methylene blue)对于疟疾有一些治疗效果。在三十年代发现的磺胺类(sulphonamide)抗菌剂同样是有机染料研究的副产品。
最初的来自有机染料的药剂是平面分子结构的,其中不可能有旋光异构结构。最近有许多药物包含一个或几个手性中心,这类化合物经常被合成出来并且它们的外消旋混合物被直接应用。事实上,在美国1980年版本的药典所列举的486种合成的手性药物中,仅有88种是单手性旋光异构体。其余的398种是外消旋混合物,仍然被用于一种具有明显单手性偏向的机体,即人体中,效果如何呢?
如果一种药物的手征性无关于它的功能,则此外消旋药物是一概有效的。在许多情形,仅有一种旋光异构体是有治疗功效的,则此外消旋混合物至多只有一半药物效用。有时发生这种情况,另一种旋光异构体不是不起作用的:它可能抑制有药效的对映异构体的功能,或者更坏,它产生单方面的有害的影响。例如,将抗疟疾药即氯奎(chloroquine)分解为两种光学活性镜像形式的成分之后,发现(+)同分异构体比起外消旋混合物更有抗疟原菌的效果,对于人体也较少毒性。
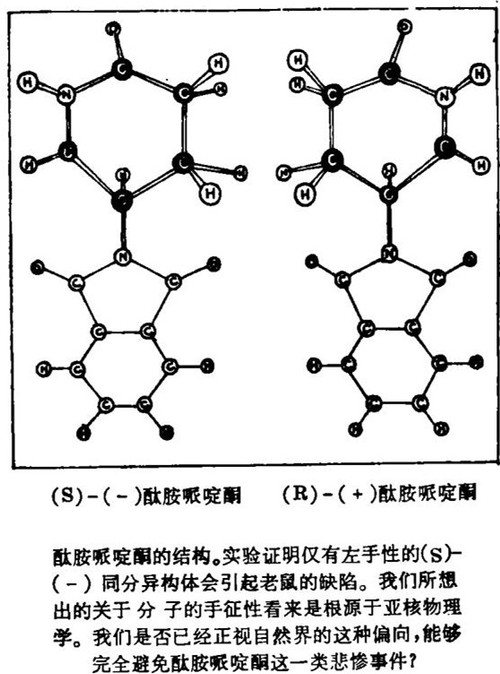
也许最悲惨的例子是酞胺哌啶酮事件。这种药物在六十年代初被作为镇静剂出售,为怀孕妇女广泛服用,她们中许多人以后产下畸形孩子。被服用的酞胺哌啶酮是两种旋光异构体的外消旋混合物。以后的研究表明,仅有左旋的(-)同分异构体有引起老鼠胚胎畸形的效果,产生类似于在六十年代早期被其毒害的孩子的那些缺陷,而它的(+)对映异构体没有这个效应。现在时过二十年,包含左旋(-)同分异构体的外消旋酞胺哌啶酮,仍然被用在治疗麻风和贝切特氏综合症(Behcet's syndrome)上。
附记 单手性化学家所用的手性催化剂
铑(Rhodium)有两种主要氧化态,即Rh(Ⅰ)和Rh(Ⅲ),是分别从中性原子中失去一个或三个电子形成的。
Rh(Ⅰ)与四个配位体形成正方形平面的络合物,而Rh(Ⅲ)的六个配位体围绕它形成一个八面体。
Hh(Ⅰ)络合物被用作为好的氢化催化剂,是因为它们与氢和烯烃(如乙烯)相结合,产生短暂的有六个配位体的Rh(HI)中介物。它们迅速分解成氢化的烯烃和原来的Rh(Ⅰ)络合物。
对围绕Rh(Ⅰ)离子的原子团作适当安排,化学家能保证氢原子仅从一侧加在烯烃的双键上。如果与烯烃中一个碳原子相键合的原子团都是不同的,则从一侧加上氢原子后将给出一种对映异构结构纯粹的化合物。
要在未来避免酞胺哌啶酮这类悲惨事故我们正在采取什么样的措施呢?从上一世纪末期埃、米尔费希尔(Emil Fisher)时代起,化学家们已经发展了两种主要的同手性合成方法用以产生单一的旋光异构体。第一种方法是采用活性生物体的同手性催化剂为实验室之用:首先是它们的酶,然后是通过重组DNA技术的整个细胞机构。在第二种方法中化学家们正拼凑设计新的手性催化剂用以合成同手性旋光异构体。在附记中所示的铑络合物就是这类催化剂,这两种先进方法的发展提供了生产纯光学活性手性药剂和其他有生物学应用的物质的前景。L多巴(L-dopa),是用于治疗帕金森氏综合症(Parkinsonian syndrome)的,现在已能通过一种手性的铑催化剂商业化生产出来。这门孤窣独鸣的艺术正逐渐成为近代合成化学和生物工艺的实践。
[New Scientist,1984年1月]