卡尔 · 兰斯泰纳(Karl. landsteiner)于1901年发现了人类血型抗原,并把人类血液分为A、B、O和AB型,从而开创了现代输血的新纪元。血型的研究,对认识迄今输血失败的原因起到了至关重要的作用。1913年奥顿伯格(Ottenberg)首先把血型血清学应用到输血实践中。他介绍了血液的可配伍性试验,但那时终因缺乏适当的抗凝血剂和储存方法,输血受到了严重的限制。第一次和第二次世界大战,促进了输血事业的突飞猛进的发展,使其成为医疗的重要部分。
血液的重要任务之一,是负责全身氧的运输,并把氧释放进组织,取代二氧化碳。所有这一切,是由红血球所含有的载氧蛋白质——血红蛋白所完成的。血液的另外组份,是在免疫反应中起关键作用的白血球和与血凝结及伤口治愈密切相关的细胞片段——血小板。
虽说输血是一个安全的常规程序,但仍有几方面的原因,要求发展血液代用品。首先,为了延长临床作用和减少细菌污染的风险,人类红血球的储存要求十分严格。这就大大限制了事故现场或战场上的血液来源。血液代用品则由于储存的要求没有那么严格,就有了用武之地。其次,血液代用品较便于消毒,以除去感染性的致病菌,而且由于不带有血型抗原,也就不需要进行交叉配血。上世纪80年代,当人们认识到人类免疫缺失病毒(HIV)是通过输血传播的时,人们对研制“无病”血液代用品的兴趣又被激发起来。在对HIV进行特异检验以前,因输血导致的艾滋病发病率是十万分之三十八。
研究人员对发展血液代用品(人造血液)的兴趣,集中到对血红蛋白载氧能力的模仿上。但除了运输氧以外,还要求人造血液:①不需要交叉配血或可配伍性试验;②便于长期储存;③在被肾清除以前,能在血管中循环几周时间;④无副作用;⑤无致病菌;⑥不但可运输氧,而且能把氧释放入组织。目前人造血液分两种。简介如下。
以血红蛋白为基础的载氧体(HBOCs)
成熟红血球内的血红蛋白,是由两个α和两个β多肽链组成的四聚体;每个四聚体结合一个含铁的血红素基;每个血红素结合一个氧分子。氧和血红素的这种结合,导致血红蛋白分子构型的改变,依次逐渐提高血红蛋白和其他氧分子结合的能力。因而,氧分压的小变化,会造成血红蛋白结合或释放氧量的大变化(如图1所示)。温度和pH值,也能改变氧-血红蛋白的离解曲线。红血球糖酵解途径中的一种产物,出现在正常人的红细胞中的2·3二磷酸甘油酸盐(2·3-DPG),也直接影响着氧和血红蛋白的结合。随着2·3-DPG浓度的升高,氧-血红蛋白的离解曲线向右偏转,从而释放进组织的氧量,比正常氧分压时的高。
血红蛋白的细胞外溶液,可用作血液代用品,因为红血球外的血红蛋白,保持了输送氧的能力。HBOCs 的最大优点是不必进行交叉配血试验。离开细胞的血红蛋白液的另一优点,是可以用超滤和低热使病原菌失活而天然红血球是不可以如此处理的。
上世纪70年代发展的血液代用品,最初是注重开发游离的血红蛋白溶液。但HBOCs的最大不足,是它在循环中存活时间短,和氧的亲合力异常高,同时还有诸如不适、腹痛、血红蛋白尿等副作用。所以要把 HBOCs有效应用于临床,还必须克服它在血管内存活时间短和向组织充氧的能力比正常血红蛋白低的问题。
首先要解决的问题,是防止不再受到红血球环境保护的血红蛋白分子被肾迅速分解和清除。红血球内的血红蛋白的寿命和红血球相同,约为120天;但溶液内的血红蛋白四聚体,易分解成单体和二聚体,并很快地被肾清除。2·3-DPC减缓了细胞内血红蛋白中氧的分解,造成人类血液的正常P50(血红蛋白半饱和时的氧分压)约为27 mmHg。在血红蛋白溶液内,由于缺乏2·3-DPC,导致氧离解曲线左转,也就是增加了血红蛋白亲和氧的能力。亲和氧的能力的增加,虽然并未限制HBOCs,运输氧的能力,但却严重限制了它向组织充氧的能力。
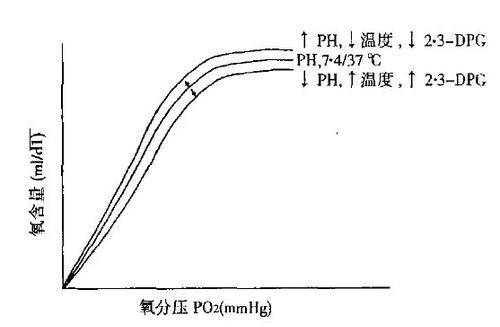
图1. 氧-血红蛋白的离解曲线。氧分压的小改变,导致自然血红蛋白结合或释放氧量的大变化。降低pH,提高温度或增加2·3-DPG的浓度,氧-血红蛋白的离解曲线向右偏。因而向组织释放氧的能力,较正常分压时提高。提高pH,降低温度或2·3-DPG的浓度,氧-血红蛋白的离解曲线向左,造成氧-血红蛋白结合力的提高。
上述两项不足,现已由用化学方法修饰过的游离血红蛋白克服了。在第一类经改造的HBOC,中,在血红蛋白多肽链之间,建起了特异的化学交联,以阻止血红蛋白四聚体的分解,从而延缓肾的清除作用。用3.5二水杨延胡索酸处理,产生强的共价键,保持了血红蛋白四聚体的完整。这样可使其在血管内的居留时间延长至12小时;而未进行处理的游离细胞血红蛋白,不到6小时就被肾消灭光了。或者,也可用双功能的交联剂,例如O-棉子糖或戊二醛处理血红蛋白;这些试剂对氨基具有特异性,井可使血红蛋白分子聚合,产生聚合的血红蛋白分子,其分子大小和构型不定,一般是由四或五个血红蛋白分子构成,在血管内的停留时间可达24小时。最后一种办法,是把血红蛋白结合进各种大分子中,例如葡聚糖,聚乙二醇或聚氧乙烯中,以延长其在血管内的居留时间,一般可达48小时。正在研究新HBOCs,包括把聚合的血红蛋白和抗氧化剂的酶如过氧化物歧化酶和过氧化氢酶相结合,以力求减少局部缺血再输血时的损伤。另外,有些研究小组还在试验把其他基因包装进入造红血球中。
目前,有三种经修饰的血红蛋白产品被提前进行临床实验。Northfield实验室,开发了一种聚血红素polyheme,是一种聚合的人类血红蛋白产物。Biopure用牛的红血球制备了聚合的血红蛋白Hemopure,已被南非共和国批准用作血液代用品,现正等待美国药品与食品检验局(FDA)的审查,欲在美国进行第三阶段的临床实验。最后是Hemosol研制的Hemolink,是一种聚合的人类血红蛋白产物,也在FDA的检验中。
利用HBOCs,必须解决几个问题。一是血液代用品中血红蛋白的来源。取自过期的人类血液(超过储存期的红血球血红蛋白显然可作为备选者),但人类血液的供给有限,严重阻碍了源于人类的HBOCs的开发。更适用的血红蛋白源是牛血。牛血不具有2·3-DPG,导致红血球内外的P50约为30 mHg(和细胞内人类血红蛋白相近)。另外,一旦把其他蛋白质除去,牛的血红蛋白不会被免疫系统视为外来成分。但牛血潜在的致命缺点是它涉嫌带有可致牛海绵状脑病(疯牛病)的朊病毒。
把HBOCs广泛应用于临床,还必须先克服几方面的困难。红血球不大可能产生胶体渗透压,而血红蛋白(如其他原生质蛋白)却具有胶体渗透效应。这样,游离细胞血红蛋白就起到了血浆膨胀剂的作用,因为它所产生的胶体渗透压,扩大了血管内的体积。多聚血红蛋白产生的渗透压要小得多。某些血红蛋白溶液也具有血管增压效应;即它们能提高血压并降低心脏输出量。几项研究显示,这种血管增压作用,部分原因是游离细胞血红蛋白液,清除了可促使血管舒张的细胞化学信使氧化氮。血管加压药的这种作用,虽大多不被应用,但对于治疗因血压低而导致败血性休克的病人却有用处。
以全氟碳为基础的产物
由于宗教的原因,有少部分人对输入供血者的血液或人类和动物的红血蛋白都不接受。这部分人如需要输血的话,唯一可选择的就是全氟碳。其分子结构和碳水化合物相似,只是由氟原子取代了氢原子。全氟碳液运载氧和二氧化碳的能力很强,而且实际上不会和这些气体结合。全氟碳现已成功地被用来向患严重呼吸窘迫综合征的早产儿供氧。
全氟碳提供了完全不同的运输氧的方式。在游离细胞的血红蛋白溶液内,氧被结合进血红蛋白内,其结合方式,和氧与自然血红蛋白分子的结合方式相同。但在化学惰性的全氟碳液中,氧容易分解,也容易被缺氧的组织提取。(图2)因全氟碳不溶于水,所以在用作血液代用品以前,要先配制成乳剂。全氟碳的载氧能力,和与乳剂平衡的氧分压成正比关系。
这样,在一定的氧分压下,全氟碳所结合的氧量要明显多于分解量。现在,全氟碳Fluosol DA已被FDA批准作为血液代用品用于心脏外科。

图2. 游离细胞血红蛋白和全氟碳乳剂的氧离解曲线。氧和游离血红蛋白的结合方式,和与自然血红蛋白的结合方式相同。相反,氧容易溶解而不能结合于全氟碳液。全氟碳的载氧能力,与和全氟碳平衡时的氧分压成直线关系。在一定的氧分压下,血红蛋白在全氟碳中结合氧的量,大于离解的氧量。
风险与利益
新的试验方法和筛选程序,使输血越来越安全了。如输血感染HV的危险,估计现已降至八十三万五千分之一。感染肝炎C病毒(HCV)的机会,降至三十万到六十万分之一;而在发展对HCV的检验之前,HCV的感染率是十万零三千分之一。但随着输血安全性的提高,对血液代用品的发展,仍需持更加慎重的态度,尤其因为新的血液代用品,可能带有未知的风险。输血用血源供应的不足,会促使血液代用品进一步发展。但要使血液代用品取代真血用在临床上的常规输血,有很长的路要走。首要的是要设法提高它在血管内的居留时间;另外,费用必须降低,制取大量这类产品的困难还有待克服。
[Science,2002年2月8日]