数据库将很快充满来自2.5万种肿瘤的基因组序列,为此,《自然》杂志编辑海蒂·莱德福(Heidi Ledford)撰文称:研究者把所面对的障碍看作是他们在数据中寻求其意义的所在
IDH1浮出水面
在2006年的一项针对35例结/直肠癌的研究中,研究人员首次发现了IDH1基因突变。当时觉得意义似乎并不大,它仅在其中的一个肿瘤标本中出现;在此后的300多例肿瘤分析中,也没有发现IDH1显示出更高的突变。曾参与这一研究的约翰·霍普金斯大学悉尼金梅尔综合癌症中心的研究员维克托·韦尔库列斯库(Victor Velculescu)说:“当时,没有人会想到IDH1在癌症发生中的重要性”。
随着对肿瘤DNA序列的扩展,IDH1突变再一次浮出水面:在脑肿瘤样本中的12%被称为多形胶质母细胞瘤中,以及在8%的急性髓性白血病标本中,均发现了IDH1突变。结构上的研究显示,这种突变改变了异柠檬酸脱氢酶的活性,引起了细胞内促肿瘤代谢产物的堆积。目前,马萨诸塞州剑桥的Agios生物制药公司正在研制有望阻断这一过程的药物。、

正是得益于高性能的基因组测序技术,肿瘤的相关突变才会被发现,尽管其过程无异于从一个草垛中寻找到一根针。在过去的两年里,全球的实验室先后测序了几千种肿瘤细胞以及来自同一个体的健康细胞的DNA序列。大约75种癌基因组已经在不同程度上测定出来,为此,研究人员希望今年年底能够完成数百种肿瘤基因组的测序。
针对癌基因组的研究,其结果无疑会产生了海量的信息。约翰·霍普金斯大学Ludwig癌症遗传与治疗中心的伯特·沃格尔斯坦(Bert Vogelstein)指出:“要找出怎样利用这些信息去帮助人们,而不仅仅是把如此众多的突变进行分类。”无论肿瘤在临床上如何相似,但大部分肿瘤在遗传上是不相同的。研究人员可以寻找一次又一次偶发的突变,或者辨认出在不同位点上突变的关键路径。但癌症基因组计划不只仅提供答案,而更多的是提出了疑问。“一旦你把一个序列中开头的几个明显的突变除去,怎样才能把剩下的弄明白呢?”贝勒医学院儿科肿瘤学家威尔·帕森斯(Will Parsons)问道,“而怎么知道哪一个突变值得去追踪并进行功能分析,那将是非常困难的部分。”
寻找突变机制
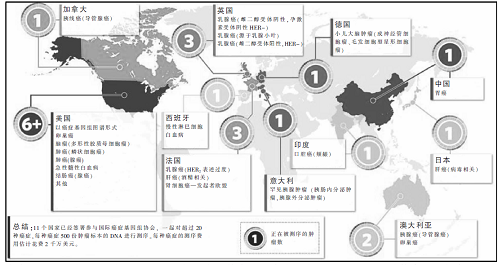
目前,国际癌症基因组协会(ICGC)正在致力于对50种癌症涉及到的2.5万个肿瘤样本进行测序。而完成这些计划预计花费10亿美元以上,已有11个国家确认参与其中的20种癌症的测序。而两个正在进行中的更大规模计划:癌症基因组计划和癌症基因组图谱(TCGA)计划,前者由英国维康信托基金会桑格研究所负责,后者由美国国立卫生研究院(NIH)牵头。其中,癌症基因组计划已完成了100个以上不完全的癌症基因组和大约15个处于不同完成阶段的完整癌症基因组,并在未来5——7年计划完成2000——3000个。TCGA在去年完成了一个3年3个癌症的小规模试验性计划后,在接下来的5年里将对20种癌症中的每种多达500个肿瘤样本测序。
由于受制于基因组数据使用权限保密条例的不同,TCGA仍不能完全参与ICGC的工作。目前,这两个团队的成员都在测序约100种肿瘤标本的一个亚类,对其余的400种将有选择地进行测序。劳伦斯伯克利国家实验室的乔·格雷(Joe Gray)说:“它仅仅是个开始。从一开始的时候,我以为做几百个肿瘤标本的研究就足够了,现在看来,即使做到1000个,很可能还得不到想要的数据。”
究竟需要多少像IDH1这样的基因才能驱动突变?研究人员认为搞清这一点将为新的癌症治疗方法提供最清晰的途径。癌基因组计划负责人之一的迈克尔·斯特拉顿(Michael Stratton)说:“假如在一特定基因中出现大量异常的突变,最可能的解释是这些突变已被肿瘤所选定,因此它们诱发了癌症。”例如,在恶性胶质瘤中,IDH1突变起明显作用的占12%。这样的结果对于总体上很少突变的癌症来说可谓富有成效。急性髓性白血病细胞的全基因组测序在蛋白编码基因方面只产生10个突变,其中8个突变先前与癌症的发生没有相关。

其他癌症的研究更具挑战性。早先的结/直肠癌数据显然忽视了IDH1的意义,直到研究扩展到其他癌症后其重要性才显示出来。沃格尔斯坦说:“很明显,现在很多肿瘤的所有基因已经被测序,能够诱发肿瘤的突变频率并不高,在癌症中低于1%。”为了寻找到这些少见的突变,取样工作就显得非常重要(500个样本中可能揭示3%的肿瘤存在突变)。斯特拉顿认为,虽然这些突变对大部分肿瘤价值不大,但仍然具有重要的生物学意义――有助于了解癌症基因组的总体概况。
另一种较常见的方式是寻找聚集在同一个通路中的突变,即一组共同作用而实现某一特定过程的基因。例如,在一组24例的胰腺癌分析中,沃格尔斯坦等人发现了12个信号传导通路发生改变。然而,他提醒说这种方法是很难开展的。因为许多通路相互重叠,其分界也不明显,而且许多界定通路的资料来源于不同的动物或细胞类型,所以它们并不总是与在特定人类组织中发现的相匹配。“在肿瘤研究中当你为揭示了一个事实而兴奋时,没想到它会引发出更多新的难题。”
多少才算足够?

迄今为止,仅有一小部分癌症基因组完成了测序。为了降低费用,大部分只覆盖了外显子组(exome),即直接编码蛋白质基因组中1.5%的基因。然而,确定基因组非蛋白编码区的重要性却相当困难,特别是科学家目前尚不知道它们的功能,而且绝大部分突变发生在这些区域。例如,在肺癌细胞系的完整基因组测序中发现的2万多个突变,只有134个发生在蛋白编码区域(见图)。斯特拉顿认为这些发现是值得的,“有可能它们与癌变没有关系,也有可能有关系,只有系统地去研究才可能知道。”
并不是每个人都同意斯特拉顿的观点。一些研究员认为,目前癌基因组计划的花费已超过其带来的益处。康乃尔大学威尔医学院的阿里·梅尼克(Ari Melnick)认为:当新一代测序仪联网后其成本将会下降,为什么不等到那时呢?哈佛医学院遗传学家斯蒂芬·埃利奇(Stephen Elledge)也认为在这期间获得的成果相当有限:如果在网上发现基因复制数以及对突变进程评估提供直观的见解时,其成本届时将变得更加廉价。
圣路易斯华盛顿大学测序专家伊莱恩·马迪斯(Elaine Mardis)说,使用快速、基于阵列的技术可以发现基因复制数目的变化,但测序技术可以提供这些区域更高分辨率的快照,研究人员可以更准确绘制插入和复制的边界,捕捉到未被阵列发现的极小的复制或者缺失。温哥华大不列颠哥伦比亚大学癌症专家山姆·阿帕里西奥(Sam Aparicio)说,任何一个对癌基因组有兴趣的研究机构现在都购买了测序仪并开始使用。
癌基因组支持者之所以不愿等到测序费用下降后开始工作,他们认为真正的工作只有在测序工作结束后才能全面开展。基于这个原因,美国国家癌症研究所去年9月制定了两个2年计划以加快工作效率,致力于发展辨认出类似IDH1突变的探针技术,用于测定TCGA小规模试验计划其突变是如何影响细胞功能的:波士顿达纳-法伯癌症中心将有系统地扩大或减低细胞培养物基因的表达,纽约冷泉港实验室则用小鼠肿瘤移植技术来研究癌症的相关突变。
目前,癌症基因组和癌症基因组图谱计划与ICGC同时对老鼠基因组基因缺失后的影响展开评估,旨在使研究人员掌握更多有关基因正常功能的信息,这种功能在癌细胞中随时会发生变化。尽管研究人员意识到这种想法很好,但认为并不全面。哈佛医学院参与TCGA计划的林达钦(Lynda Chin)教授认为,在最后的时候,我们需要研究的这些功能是能区分表格中可能潜在的相关癌基因。”
资料来源 Nature
责任编辑 则 鸣