长期以来,肿瘤生物学研究主要集中在肿瘤细胞生长的异常调控上,包括癌基因、抑癌基因等。传统的化学药物治疗方法也主要针对异常增殖的肿瘤细胞。1971年,Folkman教授首先提出了肿瘤生长和转移是血管依赖性的,阻断血管生成是抑制肿瘤生长的有效策略,由此产生了抗血管生成治疗肿瘤的设想。近些年来,随着对肿瘤血管生成机制以及对新生血管与肿瘤发展、转移关系认识的逐步深化,肿瘤新生血管已成为一个新的抗癌药物作用靶点。目前,针对肿瘤血管形成机制所设计的抗血管生成策略,已成为肿瘤治疗的研究热点。
糖类是生命有机体的重要构成成分,广泛参与生命活动的许多方面,如细胞之间的识别与粘着、信号传导、细胞增殖分化等,具有免疫调节、抗肿瘤、抗病毒、抗凝血、抗氧化等多种生物活性。近年来的研究发现很多糖类化合物具有良好的抗血管生成活性,并且有的已经进入临床研究。本文将总结近年来抗血管生成疗法的研究进展及糖类血管生成抑制剂的研究现况。
肿瘤新生血管形成机制及其调控
肿瘤生长有两个明显不同阶段,即从无血管的缓慢生长阶段转变到有血管的快速增殖阶段。在肿瘤血管形成前期,肿瘤细胞主要依赖弥散作用,通过组织间液获取从毛细血管渗透的营养物质,当实体瘤达到1mm3——2mm3 时,就需要形成肿瘤新生血管为其继续生长提供氧和营养物质,并运走代谢物质,为肿瘤细胞的扩散和转移提供了条件。
肿瘤血管形成是一个细胞和细胞、细胞与基质之间相互作用的复杂过程,主要包括以下几个步骤:1. 肿瘤细胞在缺氧的作用下,低氧诱导因子表达增强;2.促进自身各类促血管生长因子如VEGF等的表达上调,刺激内皮细胞活化,分泌出其他血管生成所需的蛋白酶,如基质金属蛋白酶等,降解基底膜和细胞外基质,内皮细胞呈游离态;3.游离的内皮细胞向着刺激因子迁移,在迁移过程中,一边破坏前进端的基底膜,一边开始形成血管的雏形;4.内皮细胞在刺激因子作用下增殖;5.内皮细胞重新排列组合成条索状,刺激成纤维细胞分泌细胞外基质,形成新的血管,并且分泌抗血管生成物质,使新生血管稳定成熟。
肿瘤新生血管的形成受多种因素的影响,目前已有几十种促血管生成因子和抗血管生成因子被分离鉴定,由两者平衡决定的“血管生成开关理论”已被广泛接受。血管生成处于正负调节因子的网状平衡控制中,促血管生成因子的增多或抗血管生成因子减少均可能启动肿瘤血管生成。
促血管生成因子
肿瘤细胞可以产生多种刺激血管生成的调节因子,包括血管内皮生长因子、成纤维生长因子、表皮生长因子、转化生长因子-β、白介素-8等。除了肿瘤细胞,肿瘤内皮细胞、基底细胞和血小板等也能分泌许多血管生成调节因子。
血管内皮生长因子(VEGF)
VEGF由Napoleone Ferrara于1989年发现并被克隆,是对血管生成影响最大的细胞因子之一,其与VEGF受体结合后,可选择性增强血管或淋巴管内皮细胞有丝分裂,刺激内皮细胞增殖、迁移,并能提高血管特别是微小血管的通透性,使血浆大分子外渗沉积在细胞外基质中,促进新生毛细血管网建立。目前发现的VEGF家族包括六大成员,即VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子,都是二聚体糖蛋白。它们的基因分别定位于不同的染色体,有着不同的生物学功能。其中,VEGF-A主要影响血管的生成,它是发现最早、研究最深入、表达最广泛、含量最高的VEGF家族成员,而VEGF-C和VEGF-D则作用于淋巴管的形成。
目前一般认为血管形成主要与VEGF-A作用于VEGFR-2有关,其可促进血管内皮细胞增殖、增殖以及增加血管通透性等。VEGFR-1的作用比较复杂,有文献报道,VEGFR-1能隔离VEGF,阻止其与VEGFR-2结合。但更多的研究认为,VEGFR-1能增加肿瘤血管中血细胞、单核细胞及其他骨髓衍生细胞的生成,从而刺激血管生成;并且有报道称,肺内皮细胞MMP-9的产生与VEGFR-1有关,这有利于肺部肿瘤的转移。
成纤维生长因子(FGF)
至今FGF家族已发现22个成员,其中FGF-1(aFGF)和FGF-2(bFGF)是最早发现的血管生成因子,也是目前其家族中被研究的最为广泛和深入的,尤其是FGF2。FGF可以和四种特异性的跨膜受体酪氨酸激酶结合而发挥作用,在血管内皮细胞上存在的主要是FGFR-1和FGFR-2。
FGF促血管生成作用主要包括以下几个方面:1. 激活蛋白激酶C和促活化原蛋白激酶(MAPK)信号传导,促进内皮细胞增殖;2. 在血管生成初期,上调蛋白酶如尿激酶纤维蛋白酶原激活剂、基质金属蛋白酶的产生,降解细胞外基质,并能调节整合素表达,阻止内皮细胞之间的连接,从而有利于内皮细胞迁移和管腔形成;3. 血管生成后期,诱导内皮细胞产生各种细胞外基质成分,并上调各种整联蛋白(包括αVβ3等)和钙粘蛋白的表达,促进细胞之间以及细胞与细胞外基质的粘连,从而使新生血管稳定成熟。
抗血管生成因子
血管生成因子的产生并不一定会启动新生血管的形成,它们被一系列的抗血管生成因子所拮制,包括血管抑素、内皮抑素、血小板反应素-1、干扰素-γ、金属蛋白酶抑制因子等。
血管抑素(AS)
AS为纤维蛋白酶原一个38 kDa的水解产物,对血管内皮细胞增殖、迁移和管腔形成均具有一定的抑制作用。用AS治疗荷瘤鼠可使多种肿瘤原发灶萎缩,并可防止转移灶的血管形成和肿瘤生长。其作用机制可能为:促进血管内皮细胞凋亡、抑制VEGF和bFGF介导的血管生成、抑制ECM降解等。
内皮抑素(ES)
ES是胶原ⅩⅧ一个20 kDa的裂解片段,其能特异性地抑制内皮细胞增殖并明显抑制肿瘤生长和转移,但对正常细胞或肿瘤细胞则无明显作用。Sund等研究表明,生理水平的ES能抑制肿瘤生长,而缺乏ES则肿瘤的生长速度提高2——3倍。ES抗血管生成的机制可能为:诱导内皮细胞凋亡、和硫酸肝素蛋白聚糖结合从而介入生长因子的信号转导等有关。
抗血管生成疗法
人的抗血管生成治疗自1988年开始以来,现全球至少有10个抗血管生成药物被批准上市(绝大多数为抗肿瘤药物),此外还有数十个药物经FDA批准正在进行临床试验。
与直接针对肿瘤细胞的传统化疗相比,抗血管生成疗法具有以下优点:1.不局限于某一种肿瘤,所有实体瘤的生长、转移都依赖于新生血管的生成,针对血管生成治疗理论上适合各种实体瘤;2.血管内皮细胞暴露在血流中,故针对内皮细胞的血管生成抑制剂可以直接发挥作用,而传统抗癌药物经组织扩散时受到组织坏死、纤维化和组织内高压等影响,常常在组织内达不到有效浓度;3.正常成熟组织毛细血管内皮细胞处于静止状态,而肿瘤血管内皮细胞增殖活跃,成年器官中新生血管生成只发生在一些特定生理条件下,如子宫内膜周期性增殖、创伤愈合,所以抗血管生成疗法毒副作用较小;4.血管内皮细胞基因相对稳定,故不易产生耐药性。
根据作用的靶点和机理不同,目前研究的血管生成抑制剂的治疗策略大致可以分为三种(见表1)。
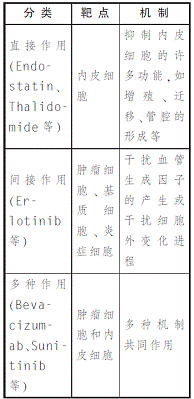
糖类血管生成抑制剂研究与展望
迄今,已发现数十种糖类化合物具有抗血管生成活性,它们来源广泛,包括动物、植物、藻类、真菌和半合成产物(糖类血管生成抑制剂的结构和作用机理略去),而血管生成抑制剂的出现则为肿瘤的治疗提供了一个全新的思路,抗血管生成治疗是对传统放、化疗的有益补充。
糖类化合物因其具有多种生物功能,近年来受到国内外学者的广泛关注。对多种糖类物质的体内外药理研究表明,它们具有良好的抗血管生成活性,并且基本无毒副作用,特别是PI-88在临床试验中的良好表现,这充分说明了糖类血管生成抑制剂研究的巨大潜力和重要价值。但由于绝大多数糖类化合物分子量大、结构复杂、在体内与生长因子、酶等作用复杂,目前很多糖类血管生成抑制剂具体作用机理不是非常明确、构效关系不够清晰,今后需要进一步的深入研究。本次承担的跟踪项目“多糖类血管生成抑制剂的发现与优化”,旨在对启明星项目中发现的抗血管生成活性海藻多糖进行进一步的结构优化,以期获得多糖类血管生成抑制剂类抗肿药物研发的先导化合物。
本文作者严君、王顺春来自上海中医药大学中药研究所
本文有删节