微型心脏、肺和其他器官宣示了药物研究和探索的光明未来
1537年,德裔瑞士人帕拉塞尔苏斯构想了一种制造微缩人的方法,微缩人“看上去会相当像人,但却是透明的,没有身体”。帕拉塞尔苏斯称呼其为“人造人”,然而生成它们的方案只是融合了炼金术和种间繁殖而已,在道德上不可接受。
如今,科学家对于人造人的概念又一次进行了尝试――但这一次他们使用了先进的生物材料、工程技术和生理学见解,诱导细胞生长成为简化却功能齐备的微型心脏、肺和其他人类器官。这些人工器官被放置在类似微芯片的装置上,由人造循环系统相连,从而生成“芯片上的人类”装置,通常而言,它们的长度不会超过几厘米。
科学家的目标是让生物材料研究重新“人类化”。一直以来,几代科学家主要和培养在平坦的人工表面――最具代表性的是聚碳酸酯这样的硬塑料,与活性材料毫无相似之处――上的单层细胞打交道,而那些人工表面又是放置在一层人工合成的细胞培养基里,其中只包含了最必要的离子、营养物质和生长因子。
不同的方法
唐纳德·因格贝尔(Donald Ingber)是马萨诸塞州波士顿哈佛大学维斯生物工程研究所的创始主任。相对而言,因格贝尔这样的研究者与同事们所设计的生物工程“人造人”旨在再现那些影响活体器官与组织内的细胞的生理结构、力量与相互作用。研究得出的试验性模型比传统的细胞培养基更契合现实使用,比实验室使用的动物更贴近人类,但仍然尺寸足够小,能放在显微镜下观察。医药探索和测试花费不菲,挑战性巨大,这类模型有望消除其中的大量初始失误和研究中进入的死胡同。
当前的药物开发体系需要进行多轮次的动物实验,有可能导致一些问题,因为人类对于化合物的新陈代谢常常与小鼠或其他实验动物非常不同。譬如说,曲格列酮最初于上世纪90年代中期在美国、日本和英国获得批准,可用以治疗糖尿病,但在导致数百名病人肝衰竭(包括了63人死亡)后,该药在2000年被撤销批准。早先的小鼠实验并未显示出药物的毒性。
真实的人类组织能够被用来补充动物实验,但组织切片存活短暂,难以获取。研究者也可以从相关的人类器官中提取原生细胞(譬如肝实质细胞),但是当这些细胞被培养在平坦的塑料上时,它们会逐渐失去功能。更令人气馁的是,器官能发挥机能,原因在于各种细胞类型之间的复杂的相互影响,而在培养基里难以再现这种复杂的相互影响,田纳西州纳什维尔范德比尔特大学的物理学家及生物医学工程师约翰·威克斯沃(John Wikswo)如此说道。“多样性十分紧要。”他说。

范德比尔特大学正在开发的“芯片上神经血管单元”实物模型
如今生物材料方面的进步使得科学家能够开始模拟这种组织过程,利用的是细胞在蛋白质纤维(命名为细胞外基质)网巢里自然排列好的过程。这些纤维不仅提供了实质的支架,还与细胞表面的受体发生相互作用,触发调节细胞生长与发育所必不可少的信号。尽管这些细胞外基质的自然结构难以复制,但是给塑料器件简单地覆盖上一层细胞外基质蛋白质,这样就能给予培养的细胞一层舒适的表面,使其附着在上面,帮助细胞恢复部分自组织能力。
自然之力
在位于剑桥市的麻省理工学院,桑吉塔·巴蒂亚(Sangeeta Bhatia)领导的生物医学工程团队研发了一种改进良多的肝脏培养模型。他们将人类肝实质细胞放置在细胞外基质蛋白质构成的岛形结构上,接着在周围放置其他细胞类型,诸如皮肤成纤维细胞,它们会与这些肝实质细胞岛发生相互作用,帮助维持肝脏特有的新陈代谢功能和基因活性图谱,在其他情况下二者会丢失。“基本上,我们能在盘中创造出微型的人类肝脏。”巴蒂亚说。这使得她的团队能够研究人类特有的病原体引发的肝脏疾病,像肝炎和疟疾这些疾病的病原体,要以模式生物来研究是相当具有挑战性的。
这些培养系统仍然缺乏真实器官的多层次三维特性,这一特征有可能显著影响组织内的细胞的行为。因此,研究者试图让培养系统更加贴近现实,使用特制的材料来增大它们的体积,甚至用细胞打印的工序来建构出组织有序、培养妥当、占据一定体积的大量细胞。通过改变酸碱度或者采用激光,多种水基水凝胶聚合物能从液态被诱导成固态,使得科学家能够把既定的细胞群捕捉到固态基质里。巴蒂亚的inVERT技术使用模具来产生水凝胶包裹下细胞的三维图样,接着在其上铺放额外的数层细胞――按顺序把不同细胞类型装配成精心设计和定制出的组织,这种方式类似于版画制作者添加一层又一层蜡版色彩,最终制作出一幅完整的艺术作品。
这些三维系统也许比传统培养皿里的培养基更具生理学上的准确性,但它们仍然无法重演许多核心器官的功能,只因它们是静态的。在身体内的动态环境下,物理力在感知环境的细胞表面蛋白质上产生压力和张力。在被人称为“力学信号转导”的过程中,那些物理力生成生物化学信号,触发细胞组织及行为的大幅变化。其中,最为普遍的现象就是血流产生的剪切力;血管内的内皮细胞在静态培养基里排列无序,但是在受到定向流体流动时,便会重组阵形,排列有序。长久以来,科学家使用生物反应器系统来复制这样的流动,但耗资巨大,仪器庞大笨重。作为替代方法,科研人员改造了那些为构建硅芯片而研发的技术与工具,研制出尺寸缩减、基于微流体的生物反应器――这些设备以玻璃和聚合物为基础,拥有微小的泵、阀门和渠道,其引导液体的方式类似于微芯片挪动电子的做法。
“芯片上的器官”系统也能驾驭其他生物学相关的力,在因格贝尔这样的研究者的工作中,尤其能清楚地看到。因格贝尔领导的团队为了在微流体装置内模拟肺的情况,在一层多孔聚合物薄膜的两侧培养了源自肺泡的上皮细胞和源自血管的内皮细胞。一侧的细胞直接接触空气;另一侧的细胞接触流动的液体。通过对芯片上相邻的孔洞周期性地施加真空,科学家能让这些薄膜上的细胞层伸展和松弛,以此反映出呼吸引起的有节奏的应变。这种人工肺接触到细菌和引发炎症的纳米颗粒时,作出的反应与人类相似,这样使得因格贝尔的团队能探索肺水肿患者的双肺内部液体积聚背后的发病机理。通过在培养模型里选择性地施加物理力,他的团队也能够用少量细胞类型来再现众多其他器官系统的真实功能。“我们要做的就是改变物理微环境而已,并且我们观察到了其他人没有见识过的行为。”他说,“我们在肠道蠕动和肾脏内液体流动的模型里见到了同样的现象,逼真和稳健的程度让我们大为惊讶。”
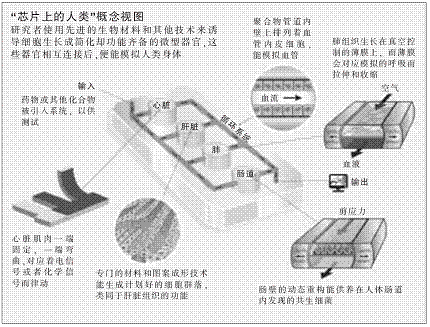
连接器官芯片
研究者说,当这些“芯片上的器官”整合在一起,成为人类躯体的简化模拟时,这种技术的最可观前景也就会到来。这种技术也许会在药物测试中发挥巨大的效益,往往一种化合物的完整影响要等到药物在肝脏中处理完毕或肾脏对药物的排泄情况都获知后,才会一清二楚。
迈克尔·舒勒(Michael Shuler)是纽约州伊萨卡康奈尔大学的一位生物医学工程师,是这一领域的先驱者之一。舒勒的研究团队使用了舒勒称之为“微观细胞培养模拟设备”的仪器,分析各种化学物质的毒性。这种仪器稳定地把细胞培养液泵入培养室之间,而后者代表了哺乳动物不同的器官系统。在最初的测试里,该团队在一套包含了肺、肝和脂肪组织的多器官设备里使用了家常可见的化学物质萘(合成樟脑丸中的活性成分)。研究揭示了萘是如何被肝脏转化成代谢物,从而引起细胞损伤、肺的衰亡――即便萘本身对肺来说是相对无害的。“假如我们把肝脏部件移除,我们不再观察得到肺组织里的细胞死亡。”舒勒说道。其他多器官系统继而诞生,从最初在多孔薄膜上的二维细胞培养发展到了更加复杂的三维水凝胶与其他基质细胞聚集体培养。
在维斯研究所,因格贝尔与同事正在致力于把大量微型器官连接起来;2014年2月,他们抵达了关键的里程碑,成功地构建了一套自动化系统,能保持10片器官芯片存活,在一周多的时间内正常运转。因格贝尔、舒勒与其他研究者也已经显示,更简单的多个或单个器官构架能存活多达一个月――足够用来分析长期接触某种化学物质或产品引发的毒性了。
然而,把多个器官芯片连接在一起,并不像搭乐高积木那么简单。最严峻的挑战包括调整这些“在活体外”系统的尺度,以便符合人类的生理机能,譬如保持适当的流体量(相对组织体积而言)。微流体系统让少量的培养液从狭窄的渠道中流过,而渠道包含了三维细胞结构,这样就能比大体积的培养系统更好地反映现实的情况,但这些系统仍然必须经过仔细谨慎的设计。“如果你把体积弄错了,突然间肝脏和肾脏就会浸没在大量培养液里,它们不知道其他器官的存在。”威克斯沃说道。相对尺寸也至关重要:构造微型的人类“芯片上的器官”并不仅仅是把每个器官缩小成一千分之一。器官尺寸是由多种多样的因素决定的,包括有机体的质量、表面积和流体体积。为了简便之故,许多研究者期望以功能性为基础来调整器官尺寸,保持器官相对符合生理学的输出量,譬如调整组织室的尺寸,这样仿真的肺随着每次呼吸会吸入适当量的氧气,而肝脏会以同比率的速率代谢生物分子。“基本上,我对每个器官都当成化学反应器一样对待。”舒勒说道。
基质材料也仍然是挑战之一。多数“芯片上的器官”和“芯片上的躯体”装置是构造在聚二甲基硅氧烷(PDMS)材料上的,这种聚合物廉价、透明、无毒、容易研发出原型。但PDMS也会吸收小分子――令人遗憾的是,其中包括了许多药物――所以势必要寻找到更加适合的聚合物材料。一种替代选项会是将用生物工程方法制造出的血管排列在芯片的聚合物渠道内,连接各个不同的器官部分。2014年秋,巴蒂亚与波士顿大学的克里斯托弗·陈(Christopher Chen)、哥伦比亚大学的戈尔达娜·伍尼亚克-诺瓦科维奇(Gordana Vunjak-Novakovic)、耶鲁医学院的卡伦·赫希(Karen Hirschi)合作研发出一种多器官芯片,其中的心脏与肝脏部分用活体毛细血管连接。柏林工业大学的乌韦·马克思(Uwe Marx)说,这样会增加至关重要的现实一面。“这些血管中的细胞也在组织之间传递信息,”他说,“血管系统不仅仅只是为器官提供营养而已。”
然而,对于到底该把什么物质泵入这些血管,研究者仍然不清楚;尽管我们身体里的每块组织都由一种常见的流体――血液――供养,寻找一种血液替代品的行动仍在进行之中,最终目的是让所培养的许多种不同细胞类型都觉得那种血液替代品普遍适合。“我们也许最终会在芯片各处使用相同的流体,但在各个器官部分局部添加独特的生长因子。”巴蒂亚说道,“那有点像身体运转的方式。”比如说,假如肺组织需要一种会对肝脏或其他细胞类型造成不利影响的生物分子,它有可能会限制生物分子的影响区域,把它储藏在一块水凝胶贮藏区,缓慢释放那种因子到进入肺脏部分的培养液里。
简单,但并非太过简单
因格贝尔强调,他的首要目标是反映器官的功能,而不是结构。“我们从最简单的模型开始做,观察它能做什么,”他说,“假如有所遗漏,我们一步步地增加复杂性,假如没有遗漏,那么我们就晓得无需增加复杂性了。”
然而,他也强调说,他的团队与维斯研究所的同事凯文·帕克(Kevin Parker)一道在追求一项崇高的目标,希望能建构出拥有尽可能多功能性的人体模型。设想中的模型会拥有能跳动的心脏,会翻江倒海的肠胃,会呼吸的双肺,所有这些器官都由一套自动化系统维持。这也许比许多研究团队要求的模型复杂得多。威克斯沃的研究团队与之相反,在研究更为简单的布置方案。“利用这些系统的终极方式,”他说,“会是让任何一位有需要的生物学家能获得小而廉价的装置。”
这个领域的许多实验室已经创立了衍生公司来研发“器官芯片”平台。2010年,乌韦·马克思与他人共同成立了以柏林为基地的TissUse公司,该公司目前为药物和毒理学测试提供两种组织芯片。因格贝尔和舒勒也已经开始创业。美国国立卫生研究院与国防部高级研究计划局共同拨款将近1.5亿美元给一项跨机构研究计划,资助“芯片上的单器官”和“芯片上的躯体”装置的研发。美国食品药品管理局也已经积极地参与进来,探索这些装置要如何适应该局的监管程序。
大多数人士都赞同,这些紧凑、直观的“芯片上的器官”装置提供了一扇真正的窗口,让人类能够窥视身体内部的运作,能让药物测试行业面目一新。日后研究者可以把传感器融入其中,利用葡萄糖水平和酸碱度追踪新陈代谢,或者精确地测量收缩肌的应变,实时测量血流流速。比如说,这可以显示出一种药物是否有可能改变病人的心率或干扰肝脏功能。威克斯沃正在与范德比尔特大学的化学家约翰·麦克林(John McLean)合作,直接利用质谱法把分子分析融入进来,确定十分钟内极小的体积内数以千计的生物分子的数量。模拟器官甚至能取下来做进一步的组织学检查,再放回原处,却丝毫不会扰乱实验。
“现在的目标是了解并理解迄今为止依靠动物实验或任何其他单细胞、单组织培养方案无法解开的疑问。”马克思说道。除了能免得让无数实验室动物丧命,这些装置也能让人类临床试验效率大大提高――比方说,在临床试验前评估试验药物,只有最佳者才继续进行一期试验。“你可以在微人类芯片上测试5到10种相关的药物,再让其中一种进入下一环节。”威克斯沃说,“假如在一期试验时,有趣的现象发生了――无论是好事还是坏事――你都能把那些装置重新拿出来,琢磨到底发生了什么事。”
威克斯沃说,最大希望在于,当静态培养基为基础的研究转变至能生成稳定的生理数据流的动态平台时,生物医学研究会从中获益。“我们希望器官芯片是靠得住的,能用于实验;尺寸足够小,能在孵育器里放入20片器官芯片;又价格足够低廉,做完实验后就扔掉也没关系。”
资料来源 Nature
责任编辑 彦 隐