
汉斯·克莱弗斯正在研究肠道、肝脏、肺等微型器官,作为一名基础生物学家,他从未想到自己的研究有朝一日能挽救病人生命
在50岁生日之前,埃尔斯·范德海杰登感到比以往更虚弱了。她出生时就罹患一种叫囊性纤维化(CF)的遗传性疾病。她努力和疾病作斗争,完成了大学学业,还找到了一份颇有挑战的咨询师工作。但是,住在荷兰小镇上的范德海杰登经常觉得“有一片乌云笼罩在头顶。”2015年,她开始感到疲劳,很容易就气喘吁吁,她觉得自己的生命可能走到尽头了。
随后,她在报纸上看到了一个名叫费边(Fabian)的CF患儿的经历。科学家剪下一段他的大肠,培育成微型器官,竟挽救了他的生命。医生们在微型器官上测试了药物依伐卡托(Ivacaftor,又名Kalydeco)的效果,这种药物很贵,如果对患者没有效果,荷兰的保险公司将拒绝赔付医疗费用。这位CF患儿是由一种极为罕见的突变导致,没有足够的资料证明该药物有效。幸运的是,他的微型器官对ivacaftor产生了反应,而他本人在服药之后几小时症状也有所改善,保险公司最终同意支付药费。
范德海杰登的医生也为她安排制作了微型器官。这个器官对市售的一种药物Orkambi有反应(成分包括Ivacaftor和Lumacaftor)。范德海杰登服药数周后,她表示:“破天荒第一次,我感觉浑身充满力量,我感到身体机能运行得像个正常人。”
这种改变命运的药物由汉斯·克莱弗斯(Hans Clevers)的实验室开发,他是荷兰皇家科学院胡布勒支研究所的主任。十多年前,克莱弗斯就发现,肠道中的一类母细胞能够产生所有类型的肠道细胞。通过给予适当的营养,他领衔的团队诱导这些干细胞发育成立体的、像铅笔头一样大小的肠道组织。这种微型器官功能与真正的肠道相似,包含了主要细胞类型,也被称为类器官。
于是,一场研究革命开始了。克莱弗斯等人开始制造其他器官的类器官,包括胃、胰脏、大脑和肝脏等。类器官便于实验室操作,能够阐明组织发育和损伤修复机制。但是,许多研究人员认为,或许更令人兴奋的是找到了一种建立疾病模型的新方法,例如研究人员向健康组织的类器官中引入特殊的突变,来研究癌症的发生。正如克莱弗斯实验室发现的那样,类器官还能预测个体对药物的反应,让个体化药物治疗成为现实。“类器官将很有可能使很多严重疾病的治疗方法发生巨大变化。”麻省理工学院的干细胞研究人员鲁道夫·耶尼施(Rudolf Jaenisch)认为。
对于克莱弗斯本人,幸运来得太突然。他认为自己是研究基础生物学的,从未想到自己研究内容的现实作用。他说:“我总是被好奇心驱使,25年来,我们发表了很多论文,但都没有转化成一个可以直接造福人类的产品。”
2017年7月的一个早上,阳光明媚,在胡布勒支研究所里,克莱弗斯正耐心地听着实验室组会的报告。一位博士后展示了她建立小细胞性肺癌类器官模型的研究工作;另一位则报告了从人体肠组织中培养激素分泌类器官的进展。一旦学生的研究问题让他感到无趣,克莱弗斯就会督促他们更积极一点。
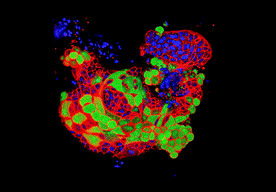
类器官能够被用来研究病原体与人体组织的相互作用。这是汉斯·克莱弗斯实验室中培养的肺类器官
“汉斯能够提出问题,而不受预设答案的影响。”爱德华·尼乌文赫伊斯(Edward Nieuwenhuis)说,他是荷兰乌得勒支中央医学院(UMCU)儿科系的主任,也是汉斯的好朋友。
“他嗅觉灵敏,总是能够找到有趣的东西。”罗纳德·布拉斯特克(Ronald Plasterk)表示,他在2002~2007年间曾与克莱弗斯共同管理胡布勒支实验室,如今他是荷兰内政及王国关系部的部长。这一研究成果给克莱弗斯赢得了许多荣誉。
研究历程
在美国达纳法伯癌症研究所做博士后研究期间,克莱弗斯的研究生涯从免疫细胞开始。1989年,他在UMCU的临床免疫学系找到了第一份工作,并且很快当上了系主任。他表示,“虽然一直从事临床工作,比如白血病诊断和血液检查,但是,我的研究兴趣主要在基础研究。”
在早期研究中,他鉴别出一种关键分子,T细胞特异性转录因子1(TCF-1),它是T淋巴细胞这种免疫细胞增殖的信号。随后,他发现,TCF-1是更大的Wnt信号分子家族的一员,这个家族不仅仅在免疫反应中不可或缺,在胚胎发育和组织修复中也发挥重要作用。1997年,他领衔的团队发现,缺少信号分子基因TCF-4的小鼠,不能发育出肠隐窝。不久以后,美国约翰霍普金斯大学的伯特·福格斯坦(Bert Vogelstein)研究发现,TCF-4也在人类结肠癌的发生过程中起重要作用。克莱弗斯被强烈地吸引住了,他把研究方向从免疫系统转向了肠道。
当时正兴起干细胞的研究热潮,受此启发,克莱弗斯开始寻找肠道干细胞。早在50多年前,研究人员就推断,啮齿类动物的肠隐窝产生了很多只能存活几天的细胞,说明这是长期稳定的细胞来源,只是没有被人们了解。
经过接近10年繁琐的实验,2007年,克莱弗斯实验室的博士后尼克·巴克尔(Nick Barker)终于有了重大发现:携带有LGR5受体的细胞产生小鼠肠道的所有细胞,Wnt信号通路中的分子指引这些细胞分裂。随后巴克尔还发现,其他器官中也存在LGR5阳性细胞。在某些情况下,这些细胞一直保持活性,而在肝脏等其他器官中,它们只有在感知到组织受损时才会增殖。
当时,培养干细胞简直难于上青天,但是,梳理了之前实验室的经验后,2009年,克莱弗斯实验室的另一个博士后佐藤户城把一些生长因子混合起来,诱导肠道干细胞在培养皿中复制。他希望看到细胞铺满培养皿,但是只有单个的LGR5阳性细胞生长了出来。“让我吃惊的美丽结构,也激起了我的兴趣。”如今在日本庆应大学的佐藤回忆说,那就是一个立体的肠道上皮组织。这个结构自组织形成肠隐窝,还有像手指状的突起-肠绒毛,并开始分泌自身的生化物质。报道这个成果的论文被拒稿数次才得以发表,克莱弗斯回忆,“当时大家甚至都不相信!”
很快,实验室开始培养来自胃、肝脏和其他器官LGR5阳性细胞,从而制造类器官。“那是一段令人兴奋的时光,我真的觉得我们处于新发现的前沿,但是我们并不认为,我们已经开辟了一个新的领域。”博士后梅瑞特谢尔·胡克(Meritxell Huch)表示。
微型身体器官
类器官是实验室培育出来的微型器官,改变了科学和医学研究。研究人员从许多不同器官中培育出类器官,还能制作来自肿瘤细胞的类器官,模拟癌症。
如何培养肠道类器官?克莱弗斯实验室利用个体患者的肠道组织培养出肠道类器官。它们可以用来测试药物的作用。第一步,取出组织样本。从肠道上皮组织里取下非常小的一块。第二步,培养。组织被浸泡在生长因子的混合溶液中,让肠道干细胞增殖。第三步,收获。直径只有1毫米或以下的类器官会在3周内生长出来,可以冷冻起来以便后续使用。
类器官有什么作用?可以将类器官用于多种不同的用途,以下是类器官在基础研究和医学中当前和潜在的一些应用:
毒性试验:利用类器官测试化学药品对肝脏及人体其他器官的影响。
微生物组研究:研究正常人的肠道细菌是如何与肠道类器官相互作用的。
建立感染模型:用病毒或细菌感染类器官,能够研究病原体对细胞的影响。
个体化药物:来自患者个体的类器官能够预测患者对药物的反应,不管是新药还是现有药物。
癌症研究:从健康组织得到类器官,再向其中引入突变,以此研究癌症的发病原因。
类器官研究方法多样化
被干细胞和再生组织的潜力吸引,其他实验室也开始制造类器官。2009年,在佐藤户城发表文章数月前,在美国斯坦福大学卡尔文·郭(Calvin Kuo)领衔的实验室中,博士后大谷秋文报告了一种生成肠道类器官的新方法。郭的方法是用组织碎片,而不是单个干细胞,把它们放在凝胶中生长,部分暴露在空气中,而不是整个浸泡在营养培养基中。同时,日本理化研究发育生物学中心的佐佐为由木培育出了第一个大脑类器官,他用的不是成体的干细胞,而是用胚胎干细胞。其他研究人员用诱导多能干细胞的方法也得到了类器官,这种细胞类似于胚胎干细胞,但是由成体细胞诱导而来的。
不同的方法造就了不同种类的类器官,各有长处和劣势。郭的类器官包含许多细胞类型,自称能够观察到肌肉收缩等高级行为。因为那些类器官含有间质组织,这是肿瘤生长所必需的结缔组织,在癌症免疫疗法等靶向间质组织的疗法研究中,它们更有用处。克莱弗斯的生长因子混合液能够促进增殖,主要形成由上皮细胞组成的类器官,所以他的方法无法适用于大脑和其他缺少或完全没有上皮细胞的组织。他的类器官也不能用于测试靶向血管和免疫细胞的药物。
但几种方法都能从个体患者身上制造出类器官,在1~3周内得到微型肠道。这些方法都是可复制的,类器官在培养过程中保持了遗传稳定性,也可以冷冻保存多年。
类器官产品开发
2013年,克莱弗斯等人创立了一家非营利性组织,胡布勒支类器官技术(HUB)来推广类器官的应用。HUB经理罗布·弗里斯(Rob Vries)表示,克莱弗斯首先提议将类器官用于组织移植。研究表明,将健康类器官移植到患有大肠疾病的小鼠身上,可以修复损伤。弗里斯说:“但是,我们没有采用这个方法,因为涉及太多法律监管上的束缚,成功的概率也很低。”
用类器官来治疗CF是UMCU学者杰弗里·比克曼(Jeffrey Beekman)的创意。所有荷兰的新生儿都要经过CF筛查,结果呈阳性的婴儿还要进行大肠活体检查,测试组织以评估缺陷基因的功能失调,然后存储起来。比克曼认为,从那些样本里培养类器官相对简单,他是这个项目的牵头人。
2 000多种基因突变都可能引起CF,结果会导致损坏细胞膜上盐和水流动的离子通道。这种病影响所有组织,但主要症状是在肺部和肠道产生很多粘液,导致胸部感染、咳嗽、呼吸困难和消化问题。
Ivacaftor以及Ivacaftor和Lumacaftor的组合药物都由美国波士顿的顶点医药公司销售,能够修复离子通道的功能,但是这些药不是对每个患者都适用,它们只是针对最常见的突变,而这些常见突变患者在CF患者总人数中大约占据一半。顶点公司一直不愿意花费数百万美元对罕见突变患者进行药物试验,因为潜在的收益很小,而成本太高。在欧洲,两种药每年花费在10万~20万欧元之间,保健服务和保险公司都不愿意为未经试验的突变患者买单。
范德海杰登就属于这一类人,在荷兰仅有其他2个人拥有和她一样的突变。但是,来自她肠道的类器官接触到Ivacaftor和Lumacaftor后,就像正常的肠道组织一样膨胀起来,这意味着有缺陷的蛋白正在工作,盐和水分可以自由穿透细胞膜。这一结果说服了顶点公司通过慈善项目免费为范德海杰登提供药品。以类器官试验为基础,CF患者埃尔斯?范德海杰登接受了新型联合用药治疗。数周后,她说:“我浑身充满力量。”
HUB与顶点公司合作,已经测试了来自CF患者的类器官对Ivacaftor的反应,这些患者都参与了这种药物的临床实验。研究证实,类器官能够预测哪些人会对药物有反应。
HUB还对50例患者的类器官进行了Ivacaftor检测,共涉及9种罕见突变。根据实验结果,保险公司同意为另外6名荷兰患者支付药费,顶点公司也开始了针对罕见突变CF患者的首例Ivacaftor临床药物实验。与此同时,HUB在荷兰健康保险公司的资助下建立了生物银行,保存了1 500个荷兰CF患者的类器官,用于检测现有药物和新药。
“这是CF研究中的一件大事。”耶路撒冷哈达萨医学中心的儿科学领头人埃坦·凯雷姆(Eitan Kerem)表示,她也在建立类似的生物银行,并在罕见突变患者中进行了试验。类器官格外有用,因为CF没有较好的动物模型。凯雷姆表示,“只好用白鼬和猪作为模型,但是它们成本很高,大部分研究人员不易获得。”
制药和生物技术公司正在积极与HUB合作,探索类器官在其他疾病研究上的用途。在CF上的成功表明,他们可以建立其他单基因异常的模型,比如α-1抗胰蛋白酶缺乏(主要导致肺部和肝脏异常)。有些公司正在类器官上检验失败的药物,与动物实验和临床资料比较,希望找到能够预测和避免失败的方法。
类器官为癌症研究提供模型
癌症也是类器官研究的主要目标。从肿瘤样品中得到类器官,研究人员就得到了微型肿瘤,利用其来研究癌症成因,检测药物等。
2009年,在微型肠道文章发表之后不久,纽约冷泉港实验室癌症中心主任大卫·图文森(David Tuveson)开始推动克莱弗斯去制造胰腺癌的类器官。众所周知,这种癌症非常难以治疗。图文森认为,现有的细胞培养模型都不能现实这一目标,创造基因工程的小鼠需要一年时间,而类器官只需要3周。类器官已经帮助阐明了导致胰腺癌的新途径,未发表资料表明,它们能帮助研究人员预测哪些疗法更有效果。他与克莱弗斯正在试图通过添加间质组织和免疫细胞,制造与真正癌症相似的类器官。胡布勒支实验室也参与了两个实验,评估来自患者个体的结肠癌类器官能否预测药物反应。
纽约纪念斯隆凯特琳癌症研究中心的查尔斯·索耶斯(Charles Sawyers)正在试图制造前列腺癌类器官,但是很难,来自原发肿瘤的类器官通常不会生长,而来自转移组织的肿瘤虽然能够生长,但是正常细胞往往比癌细胞长得好。迄今为止也不过在20个患者身上获得成功。但是索耶斯发现,他能轻易地得到正常前列腺组织的类器官。“这方法很有效,”他说,随后运用CRISPR等基因编辑技术能研究他需要的任何突变,他表示,“这是肿瘤抑制基因吗?这是癌基因吗?它是与基因XY协作吗?你可以玩这种游戏!”
其他癌症研究人员也想要加入。图文森收到了很多培养类器官的请求,他开始在实验室举办定期研讨会。2016年,美国国家癌症研究所、英国癌症研究中心、英国桑格研究院和HUB还一起启动了一项计划,培育包括类器官在内的1 000多个细胞培养模型,提供给全世界科学家。
用个体化的类器官来治疗癌症仍然面临许多障碍。各种癌症类器官培养时间不同,但都需要尽量缩短时间,同时患者承担的成本也有减少的需要。此外,癌症在发展过程中积累了大量基因突变,来自患者早期癌症的类器官有可能不能反映随后的状态。图文森表示,“虽然如此,我认为这是癌症研究领域最具变革性的进步。”
也许这些成果本应令克莱弗斯很激动,但他很少会表露出来。在谈到自己的研究时,他很少使用富有情感的语言,更倾向描述和解释事实。亲密的朋友有时也会觉得他的实用主义令人费解,“他谈论自己的研究,就像某些人谈论拧螺钉一样平淡无奇。”而克莱弗斯则表示,“发现一些新颖事情,已经使我得到了高度满足,而不管实际用处有多大。”
资料来源 Science
责任编辑 游 溪