结节性硬化综合征(TSC)是一种严重的疾病,临床表现为不同器官的肿瘤,常见的有:皮肤血管纤维瘤,脑部位的脑皮质结节、室管膜下结节(SEN)和室管膜下巨细胞星形细胞瘤(SEGA),心脏横纹肌瘤,肺脏淋巴管平滑肌瘤(LAM)以及肾脏血管平滑肌脂肪瘤和肾细胞肿瘤。神经病学表现则为癫痫和TSC相关神经精神障碍,包括攻击行为、孤独症谱系障碍、智力缺陷和其他精神障碍。
TSC由杂合胚系突变导致TSC1和TSC2基因失活引起,这些基因的蛋白质产物在正常情况下通过机械靶向作用负性调节雷帕霉素复合物1(mTORC1)。因此mTORC1抑制剂常用于治疗TSC脑、肺和肾脏肿瘤以及癫痫患者,但并不能治疗所有症状,而脑部肿瘤如何产生仍不明确。
奥利弗 · 艾希穆勒(Oliver L. Eichmüller)等人发现了一类前体细胞,能够生成皮质结节样和室管膜下肿瘤样细胞,让我们能够更好地理解TSC的神经病学表现。
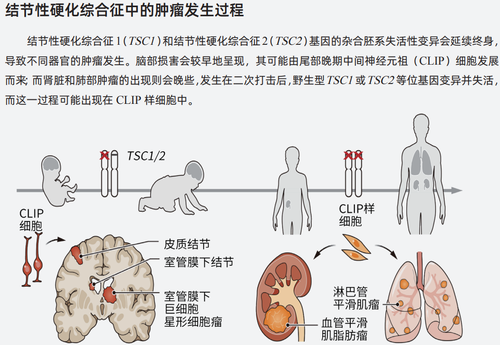
临床上TSC患者还有很多问题亟待解决,尤其是复杂的神经系统临床表现。尽管许多神经病学表现在出生后很快出现,但其原因仍不明确:是出生前的细胞发育问题,还是因为如突触修剪、白质成熟和神经环路连接等在出生后的过程出现问题?该领域研究的障碍是如何通过模型再现TSC的脑部畸形和神经精神病学特征?许多动物模型同患者的临床表现存在差异,譬如说动物模型需要其他肿瘤抑制基因失活以再现肿瘤发生过程,或是在没有明显皮质结节存在的情况下产生了癫痫。脑部错构瘤(包括SEN、SEGA和皮质结节)的发生机制也不确切。而在几乎所有的肾脏和肺部肿瘤中几乎都发生了二次打击事件,它使剩余的野生型TSC1或TSC2基因备份失活,其发生时间往往会更晚一些(见图)。二次打击被认为是肿瘤发生的必要条件,它使mTORC1的活动失去限制。许多SEN和SEGA中能够检测到TSC1或TSC2基因遭受到二次打击,而在皮质结节中则并非如此,因此这类事件是否是病理机制的必要条件并不明确。
TSC一些临床表现的细胞起源(包括血管平滑肌脂肪瘤、LAM和脑部错构瘤)界定并不清晰。另一个尚不明确的问题是TSC是否会被性别、免疫渗透、基因修饰、饮食和环境暴露等因素影响。表型和严重性并非严格基于基因型——同一家系的TSC患者在临床表现上也会有很大差异。这些未知因素影响着该疾病基础研究中疾病模型的优化进程。
艾希穆勒等人利用TSC患者的细胞获得了诱导多能干细胞(iPSC),并分化出不同的神经细胞系,以此培养类器官——一种三维的细胞培养物。这种类细胞再现了TSC的两种临床表现:与SEN或SEGA相似的增殖损害,以及与皮质结节相似的巨细胞。研究者利用单细胞RNA测序技术鉴定到一种细胞,推测为这两种损害共同的起源细胞,称为尾部晚期中间神经元祖细胞。CLIP细胞表达低含量的TSC2,因此可以推测其对TSC2的一个等位基因的失活更为敏感。CLIP细胞和周围增加mTORC1的活性和对肿瘤发生易感性的祖细胞群在转录上则是相分离的。研究者认为脑部损害最初由CLIP细胞组成,但其他细胞类型会在疾病进展过程中出现。
CLIP细胞的发现以及其是皮质结节和室管膜下肿瘤的前体细胞的假说,称得上是理解TSC神经病学表现之路上的重大突破。这些发现和近期其他人类胚胎干细胞培养成皮质球状体的研究大相径庭,展示了需要TSC1或TSC2的两个等位基因失活,才会导致细胞分化的改变以及异型细胞的出现,支持了结节发生的二次打击模型。这提示结节发生的机制并不单一,且可能取决于发育阶段,人类iPSC分化得到的肾脏类器官在研究中能够发展出血管平滑肌脂肪瘤样的肿瘤,但需要预先设置TSC2双等位基因的失活,这证实了二次打击的必要性。当类器官模型和患者组织病理学研究不断进展,重要的问题将会是:其他TSC相关的肿瘤是否也存在CLIP细胞样的特点,包括低含量的TSC蛋白,以及TSC基因的二次打击是否是肿瘤发生的必要条件。
目前仍不明确CLIP细胞是否有可以进行靶向治疗的特征。尽管CLIP细胞内表达表皮生长因子受体(EGFR),艾希穆勒等人发现抑制EGFR将会阻止类器官中损害的发生,而脑内其他祖细胞群也会动态地表达EGFR,但却对TSC2突变的易感性更低。TSC患者各类皮质下肿瘤发病率存在差异则指向另一个问题:如果TSC2杂合细胞中的CLIP样状态足以诱导所有脑部错构瘤的发生,为什么更多的TSC患者罹患SEN而少数发展出更大的SEGA肿瘤呢?免疫浸润——尽管还未在TSC类器官中发现——或许是这一现象及其他临床特征发生的重要调控因素。类器官模型的进一步优化或将解答这些问题,让我们对TSC以及其他罕见的疾病有更深刻的理解。
我们有必要比较一下艾希穆勒等人发现的细胞类型和近期人类发育学单细胞研究结果的匹配程度。尤其是细胞条形码和谱系示踪技术的新数据显示,脑发育过程中神经细胞系会在不同亚区域生长发育,过去认为它们由皮质祖细胞或是尾部神经节隆起祖细胞(能够进一步分化为CLIP细胞)分化而来,实际上二者却能够单从皮质祖细胞分化而来。如果发育中CLIP样状态能在多个细胞系中同时出现,那么就需要重新思考TSC肿瘤发生的地点和方式。
资料来源 Science