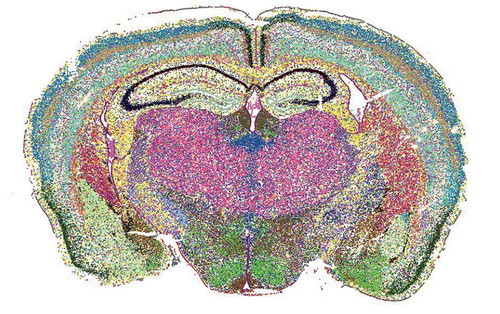
科学家正结合单细胞测序和基因表达空间定位的技术,揭示脑细胞令人惊叹的多样性。
空间转录组学技术MERFISH展现小鼠脑切片中各式各样的细胞簇
圣地亚哥 · 拉蒙-卡哈尔(Santiago Ramóny Cajal)在19世纪后期极为细致地描绘了神经组织,对神经生物学产生了革命性的影响。这位西班牙生理学家和科学家花费多年时间,一丝不苟地利用显微镜进行研究,通过图像展现脑中独特的细胞形态学。
“卡哈尔的工作让我们意识到脑中的细胞与众不同,细胞形态与其他器官的截然不同,这在其他地方是看不到的。”马萨诸塞州坎布里奇麻省理工-哈佛大学博德研究所的神经科学家埃文 · 马科斯科(Evan Macosko)评价道。
拉蒙-卡哈尔绘制的图像为脑如何实现其功能提供了最初的线索:脑从调控血压和睡眠到控制认知和情绪,或许都能够定位到细胞层面。
然而,脑的关键信息却依旧是空白。哈佛大学生物物理学家庄小威认为:为了从基础层面理解脑,我们迫切需要明确其中的细胞种类、细胞的组织方式,以及细胞间如何交互。
庄小威继续解释道,神经科学家需要的是一种系统鉴定脑细胞种类,并绘制图谱的方法。如今研究者正接近这一目标(至少在小鼠脑中)。通过结合高通量单细胞RNA测序和空间转录组学——这些技术能够鉴定单个细胞内的基因表达情况,以及这些细胞的定位——研究者正绘制迄今为止最为全面的小鼠脑图谱。关键的后续步骤在于研究这些分子水平鉴定得到的细胞种类的具体功能,并结合各种脑图谱以创建统一的图谱资源,广泛应用于神经科学研究领域。
绘制脑图谱
小鼠是极为强大的实验平台,神经科学家可以在小鼠中以各种无法在人脑中实现的方式研究脑的功能。光遗传学(利用经过基因改造的实验动物,科学家可以通过光来控制细胞的活动)等工具能够探究特定神经元如何影响行为,而这些操纵手段无法用于人类,也不符合伦理规范。
单细胞脑图谱通过基因表达谱鉴定细胞种类,这种方法可以沟通这两个物种。斯德哥尔摩卡罗林斯卡研究所的神经科学家司登 · 林纳尔松(Sten Linnarsson)表示,如果研究者对人类的特定细胞种类感兴趣,可以利用基因表达模式寻找到小鼠中的同种细胞,并加以操纵。基因表达同样为研究者提供了一种鉴定脑细胞更加细致的方法,使得传统上利用物理结构、定位、细胞连接和放电模式的方法显得相当粗糙。
林纳尔松等人利用单细胞RNA测序绘制了这种综合性的图谱。早期研究主要聚焦特定脑区,比如大脑皮层——这是脑的外层。接着在2018年,两个研究团队将这种技术拓展到了全脑水平。林纳尔松团队的一个研究对小鼠脑细胞、脊髓和外周神经系统中接近50万个细胞进行了分析。利用计算机算法基于基因表达模式对细胞进行分类,研究团队发现了265个“细胞簇”,每个簇代表一种在分子水平上不同的细胞种类。而马科斯科参与其中的哈佛大学医学院和博德研究所的另一项研究,则在69万个小鼠脑细胞中鉴定得到了565个细胞簇。
这些细胞簇中包含一些从未被报道过的细胞类型。以林纳尔松的研究为例,发现了7种星形细胞,这是一种非神经元细胞,功能相当丰富,从为神经元提供能量到维持神经元连接。而在这之前,科学家只鉴定出4种主要的星形细胞种类。
然而,明确存在的细胞种类并不等于明确其定位。“两篇论文中都缺乏空间维度。”马科斯科评论道。
研究者需要一种方法在鉴定每个细胞中基因表达的同时,还要精确定位细胞在脑中的位置。这时,空间转录组学便有了用武之地。
描绘细胞多样性
2015年,庄小威团队首次公布了一种空间转录组技术——多重抗误差矫正荧光原位杂交(MERFISH)技术。该技术为每一种RNA分配条码(一个独特的DNA探针),并进行数轮显微成像系统性地破解条码。这些条码具有“抗误差”的功能:这些序列即使被误读数次,也不会被错认为其他条码。
MERFISH能够在培养的人类细胞中同时解析超过1 000个基因,研究者也尝试利用这一技术解析小鼠的脑,建立特定脑区的图谱并比较鼠脑和人脑间的细胞组织差异。此外,他们还发现人的部分大脑皮层相比小鼠对应脑区,含有胶质细胞(一组非神经元细胞,包括星形胶质细胞和小胶质细胞——脑中特有的免疫细胞)的比例更高,以及人大脑皮层神经元和非神经元细胞间的交互相对于小鼠要更多。
现如今,庄小威和同事们将MERFISH技术应用于全脑水平。研究团队利用这一技术解析成年小鼠脑中约800万个细胞,并将这些数据与同一批细胞的单细胞RNA测序数据相整合,发现了超过5 000个具有不同转录组特征的细胞簇。研究团队于2023年3月将这一结果以预印本的形式发表于《生物学档案》(bioRxiv),这些研究的正式结果也正陆续出版。
小脑切片的荧光显微照片
另一个同类研究由华盛顿西雅图艾伦脑科学研究所所长曾红葵指导进行,同样将单细胞RNA测序与MERFISH技术相结合。(曾红葵和庄小威的研究团队都参与了上述两项研究。)尽管这两项研究应用的技术相似,关注的其实是不同的问题。第一个研究的重点在于空间梯度——这是一种细胞簇间的基因表达谱的渐变特征,以及空间模块,即分子水平上具有差异的脑区。第二个研究则通过DNA结合蛋白,即转录因子来鉴定不同的细胞种类。“我们的结果仅仅是皮毛,”庄小威表示,“这一数据集为脑的分子和细胞结构提供了丰富的见解,也为将来的研究提供了富有价值的资源。”
第三个研究则由马科斯科和同事完成,他们利用一种不同的空间组学方法。马科斯科并没有使用依赖显微镜的MERFISH技术,而是采取Slide-seq测序方法。这一技术能够将组织样本中的细胞RNA高效地转移到种满微珠的表面,而这些微珠带有条码标记。研究人员可以利用已知的带条码微珠的定位,明确组织中相关RNA的具体位置。而将这种技术和单核RNA测序相结合,就能够报告细胞核中的基因转录情况,而非整个细胞的情况。由此,马科斯科团队绘制了自己的小鼠脑图谱。
这三项研究或多或少都受到了美国国立卫生研究院(NIH)脑计划细胞普查网络(BICCN)的资助,这项计划支持实验室绘制小鼠及包括人类在内的灵长类脑的综合图谱。而三项研究都指向相似的结论:小鼠的脑在细胞多样性上相当复杂,这种复杂性更加体现在皮层外的其他部分。研究团队发现皮层中细胞的种类更少,不同种细胞所具有的转录特征差异性更大。而位于脑底部的下丘脑、中脑和后脑等区域则具有更多种类的细胞,且细胞间差异性更小。
曾红葵推测这些差异源自这些区域不同的演化史。下丘脑、中脑和后脑等区域主要负责重要的生理功能,譬如进食、代谢和运动,这些功能在动物间是保守的,因此具有相对固定的细胞配置,长时间以来形成不再变化的高度特异细胞。但皮层则负责更高级的认知功能,负责适应环境变化,这些细胞出现差异化表现的频率就会更高。
马科斯科的数据目前公开发布在braincelldata.org,另外两项研究的数据则在brainimagelibrary.org;同时,庄小威表示艾伦研究所计划2023年发布一个新的交互网站。
“这些绝对称得上美妙的研究,”卡罗林斯卡研究所的神经科学家康斯坦丁诺斯 · 美莱迪斯(Konstantinos Meletis)评价道,“这些研究说明目前可以利用大规模靶向方法同时理解成百上千的基因的空间组织形式。”美莱迪斯和同事们在三年前发表了自己的小鼠全脑图谱,他们用到了不同的空间转录组方法。(这项研究没有在单细胞水平绘制全脑图谱,但在特定区域内说明了这项技术可以与单细胞RNA测序相结合以获得细胞水平的分辨率)。
超越基因表达
“单细胞基因表达图谱是神经科学领域的无价之宝。”曾红葵评价道。从分子特征角度准确定位特定细胞种类后,神经科学家便可以此开发工具研究健康脑中特定细胞的功能,并进一步研究疾病状态下的情况。
而研究者正绘制的图谱可不止这一种。
加州大学圣地亚哥分校的分子遗传学家任冰与加州拉荷亚索尔克研究所的分子生物学家乔 · 埃克(Joe Ecker)合作,绘制了小鼠脑的表观遗传学图谱。埃克的实验室开发了一种检测DNA甲基化(一种DNA上的化学修饰,能够改变基因表达)的工具,适用于单个细胞的整个基因组,而任冰团队则设计了一种解析染色体可及区域的工具,能够标记活跃的基因表达和调控区域。“我们希望通过不同细胞类型中的甲基化情况,从另一角度定义细胞的身份,”任冰表示,“这种方法在鉴定不同脑细胞的同时,也能更综合地理解每种细胞类型基因调控的机制。”
任冰和埃克将这些技术相结合,在小鼠脑中鉴定出了超过4 000种细胞簇。研究团队于四月在《生物学档案》(Archives of Biological Sciences)上发表了这项研究,报告了他们发现的细胞种类与空间转录组学技术的鉴定结果很相似。这项研究同样是BICCN计划的一部分。
与此同时,中国科学院神经科学研究所的神经科学家严军和同事正在绘制脑内神经元细胞间的远程连接,即“投射组”图谱。他们开发出一种计算机算法,在小鼠的前额叶皮层(在人类中对应的脑区参与决策、情感和感知等功能)中通过追踪轴突(将信号从神经细胞胞体中传递出去的长纤维)的投射鉴定出这些神经元连接。研究团队进一步将研究范围扩展到树突(神经细胞接受信号的枝干),并将全脑的投射组作为目标。
“神经系统是一个网络,”严军解释说,“而网络的功能取决于其连接性。”
还有一些科学家在这一领域耕耘已久。美国赫尔希宾夕法尼亚州立大学的神经科学家金永洙(Yongsoo Kim)正利用高分辨率成像技术绘制小鼠脑从胚胎阶段开始的发育全过程的3D图谱。金永洙表示,目前只有一个成年小鼠脑的“极好的”参考图谱——艾伦小鼠脑通用坐标框架,该框架由1 600个鼠脑的高分辨率图像制成。但这一图谱也只代表某个单一的时间点。金永洙团队希望通过绘制更加通用的坐标框架,为绘制不同发育阶段的小鼠脑图谱提供模板。
从小鼠到人
目前,研究人员正将这些技术用于更大型的哺乳动物,包括人类。NIH 2022年宣布投入5亿美元资助脑计划细胞图谱网络(BICAN),以建立更加综合的人脑图谱。
但绘制人脑图谱的挑战更大:一方面,人脑相对于小鼠脑的细胞数量估计要多上千倍。同时,科学家处理人脑组织的实验手段也有限——组织样本必须来自尸脑样本,同时人类样本相比实验小鼠的异质性更大,实验小鼠往往具有一致的遗传背景,饲养环境也类似。
尽管如此,人脑研究已经带来了新发现。林纳尔松和同事在一项分析中利用单核RNA测序调查人脑中300万个细胞。研究结果于2022年10月在《生物学档案》中上线,他们发现人脑的中脑和后脑等区域中细胞种类相对于皮层更多,这与小鼠中发现的一致。“我们在人类中往往采取一种皮层为中心的观点。”林纳尔松评价道,但这些发现提示研究者应该更加重视其他常被忽略的脑区。
与此同时,研究者继续深入研究空间细胞图谱,探索这些新鉴定得到的细胞种类的功能。譬如庄小威团队,正在探究不同细胞种类的空间临近关系以及它们的基因表达模式,以推断细胞间的交互作用,这能够为剖析各种脑功能的分子和细胞机制提供重要的线索。同时马科斯科表示他的团队正在开发一种算法,用于决定区分细胞种类所需基因数的最小值——犹如是给神经科学家一本实验用的“食谱”。
研究者甚至可以通过挖掘这些图谱的数据开发疗法。目前精神和神经疾病的治疗方法倾向于使用粗略的细胞分类方法——例如靶向多巴胺能或血清素能神经元。但上述的图谱提示我们脑中细胞有上千种,其中或许就隐藏着调控人类行为的全新方法。“从治疗的角度来看,”马科斯科说,“我们在这一领域中有很大的机会研究发现不同的细胞种类如何影响认知、情绪,以及其他的生理学机制。”
资料来源 Nature