本篇报道围绕2022年上海市自然科学奖一等奖项目“环形RNA生成和功能机制的研究”展开,该奖项由中国科学院分子细胞科学卓越创新中心陈玲玲研究员领衔获得。她在非编码RNA领域深耕十余年,见证并推动了这个领域的发展。她领衔的团队发现了不带有多聚腺苷酸(polyA)尾巴或者N7-甲基鸟苷(m7G帽子)的非经典lncRNA新种类,包括sno-lncRNA、SPA RNA、circRNA等,并在阐明这些RNA的生物合成机制与功能、探索其生物医学应用方面成绩斐然。
陈玲玲说:“我现在45岁,我希望我的研究还能再有突破。”
在过去30年左右的时间里,非编码RNA一直是非常活跃的研究领域。从获得诺奖的小RNA干扰技术,到近年来备受关注的lncRNA,形形色色的非编码RNA在各种各样的生物学过程中发挥重要功能,并展现出多种多样的生物医学应用前景。
然而,究竟如何才能做好RNA研究?中国科学院分子细胞科学卓越创新中心研究员、分子生物学国家重点实验室副主任、核糖核酸功能与应用重点实验室主任陈玲玲与您一起走进RNA的世界。
RNA大家族:不只编码蛋白质
非编码RNA有哪些种类?这个领域的研究历程大概是怎样的?
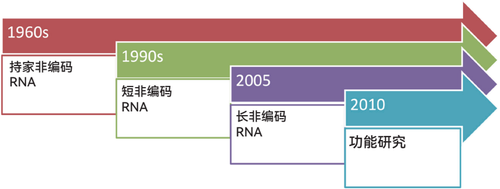
非编码RNA研究可以分为几个阶段。第一阶段是从20世纪60年代到80年代。这一时期,人们陆续发现了不同类型的持家非编码RNA,例如我们熟悉的核糖体RNA、转运RNA、小核RNA、小核仁RNA等。这些持家非编码RNA在细胞中的含量比较高,而且承担着非常重要的生理功能。
第二个阶段是从20世纪90年代初到2005年,这一时期人们陆续发现了一系列小非编码RNA,包括能够沉默基因表达的miRNA、与哺乳动物生殖有关的piRNA等。进一步的功能研究显示,这些小非编码RNA可以应用于基因表达调控、育种、基因治疗等许多领域。
事实上直到现在,人们对小RNA的研究也仍然没有停止。2006年,安德鲁 · 法尔(Andrew Fire)和克雷格 · 梅洛(Craig Mello)两位科学家因在小RNA干扰领域的研究获得了诺贝尔生理学或医学奖。2018年,美国食品药品管理局(FDA)批准了第一款小RNA药物,用于治疗由转甲状腺素蛋白淀粉样变性引发的神经损伤。
非编码RNA研究的第三个阶段大概是从2005年到2015年,是lncRNA等更多种非编码RNA大规模发现的阶段。这是因为在2005年左右,人们开始使用覆瓦式阵列(Tiling Array)等基因组学、转录组学的方法对基因组进行大规模测序,发现以前认为不转录的基因区域实际可以被转录,产生了众多与编码蛋白质的信使RNA类似——带有5′端m7G帽子和3′端polyA尾巴——但不编码功能蛋白质的长非编码RNA。目前人们已经发现了数十万条不同的lncRNA。后来,包括我们团队在内,人们又发现具有特殊结构的长非编码RNA分子家族,它们不带m7G帽或者polyA尾巴,例如我们研究比较多的、两端以小核仁RNA结尾的sno-lncRNA和circRNA等。
非编码RNA的发现与研究历程
从2010年到现在,人们开始更多地关注和研究lncRNA的生物学功能。对于形形色色的非编码RNA,人们尝试去研究它们在不同的细胞环境下与哪些蛋白质相互作用,折叠成怎样的构象,又是以何种机制去发挥怎样的生理学功能。对于这些问题,目前还不能用一个通用的法则来比较简单地阐述相关机制和规律,因此我认为对于RNA研究者来说,目前是一个充满挑战、非常重要的阶段。
将来还会发现新类型的非编码RNA吗?
我觉得可能会。按照非编码RNA的长短,我们可以非常宽泛地把它分为长非编码RNA和短非编码RNA,而在这样的大类之下,不同的RNA有不同的来源,它们来自不同的细胞,有不同的生物合成方式,折叠成不同的构象,运用不同的作用机制,发挥着不同的生理病理功能。我认为在目前研究比较少的体系中,比如极端生物、动植物生理病理以及人体内部的一些细胞亚型中,很可能还会发现由不同的生物合成途径产生的新类型的非编码RNA。
您是如何进入这一研究领域的?在领域中做了哪些比较好的工作?
我的研究经历中有一些机缘巧合,但又是一脉相承、有迹可循的。
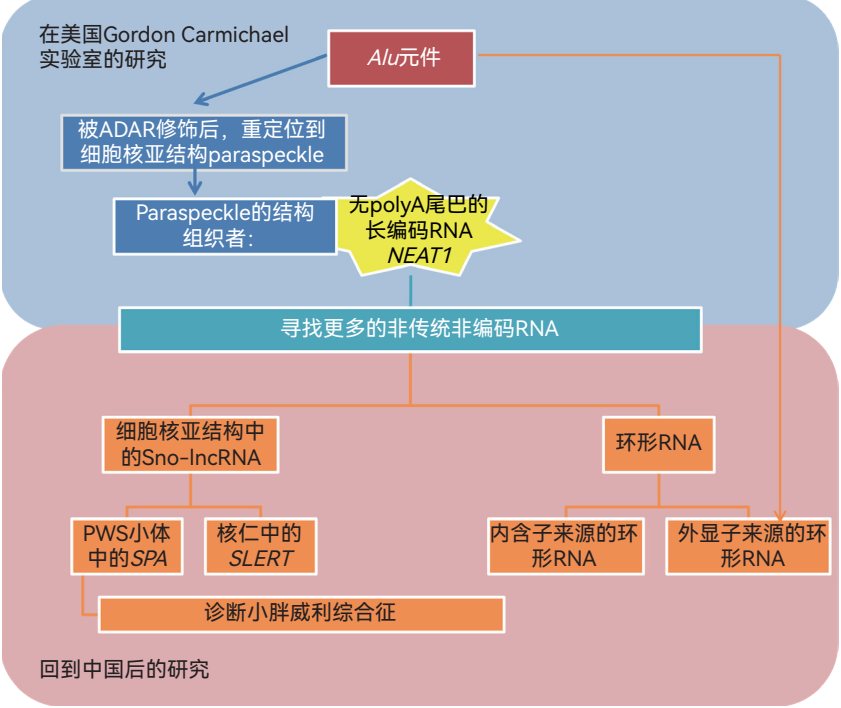
我2004年到美国读研究生的时候,导师戈登 · 卡迈克尔(Gordon Carmichael)教授是做病毒学研究的,而我的研究对象是实验室刚开始关注的基因元件Alu。Alu是灵长类动物基因组中特有的一类细胞核短重复序列(SINEs),它们在基因组中的占比可以达到10%~11%。我当时发现,mRNA 3′端区域含有反向重复的Alu元件,可以导致这样的mRNA亚细胞定位发生改变,它们不再出核,而是停留在细胞核中一个名为paraspeckle的亚结构中,随后我和其他的团队研究发现,paraspeckle的结构组织者之一正是lncRNA,叫做m7G。这就是我与非编码RNA最初的接触。而巧合的是,在当时已经发现的一万多种lncRNA中,只有两种没有polyA尾巴,而m7G就是其中之一。于是我就想问:转录组中是不是还有其他没有polyA尾巴的新类型的非编码RNA?
当时,我博士刚毕业就获得了20万美元的研究经费,利用这笔经费,我在博士毕业后仍然留在卡迈克尔实验室,半独立地开展研究工作。2011年,我们在《基因组生物学》(Genome Biology)杂志发表文章,报道了建立无polyA转录组分离纯化的方法和我们在基因组范围内搜索non-polyA RNA的结果,发现了大量源于内含子和外显子的无polyA的RNA信号。
在这个时期,2010年底,我也在中国科学院分子细胞科学卓越创新中心(原中国科学院生物化学与细胞生物学研究所)建立了我的研究团队。“什么机制导致这些无polyA外显子和内含子序列稳定存在”是我建立实验室之初想要回答的科学问题。
2012年,我们在《分子细胞》(Molecular Cell)上报道了两端以小核仁RNA结尾的sno-lncRNA新家族。从sno-lncRNA出发,我们开始关注与之相关的细胞核亚结构,其中有两个比较重要的工作:一个是发现多个sno-lncRNA及类似的SPA lncRNAs在小胖威利综合征(PWS)患者体内缺失,除了解析它们可能的分子机制,我们最近也证实了它们的缺失可以作为检测这种疾病的标志物;第二是我们对定位在核仁的一个sno-lncRNA——SLERT进行了一系列研究,解析了它在核糖体RNA转录调控和核仁结构维持中的重要作用,发现了新的致密纤维组分外侧区域(PDFC),拓展了对于核仁的认识。
在2013、2014年发表的两篇文章中,与计算生物学家合作,我们先后报道了内含子来源和外显子来源的环形RNA。其中外显子来源的环形RNA之所以能够成环,是因为在外显子两侧的内含子上有互补的顺式作用元件Alu重复序列,Alu元件形成瞬时配对将外显子的两端拉近从而帮助其环化。这显然又是一个巧合,正是因为我自己以前研究3′ UTR Alu元件,我们才能在几年之后重新遇到它的时候,较快速地阐明这类环形RNA的产生机制。
从2013、2014年到现在的十年中,我们持续在研究环形RNA,通过系统阐明环形RNA加工、折叠和降解特性,将环形RNA的生成与作用机制相耦联开展研究,从而揭示了其全新功能,并探索其与自身免疫疾病的关联。
以上就是我在这个领域的主要研究经历。从分子发现开始,到后面进行功能机制研究,再到发现它的临床应用潜力,这是一个非常充实、非常有趣的科研经历。
陈玲玲的RNA研究经历
lncRNA研究:尚无规律认知,需要小心谨慎
非编码RNA在生命系统中扮演着怎样的角色?它们和蛋白质谁更重要?
首先持家非编码RNA肯定是非常重要的,它们是维持生命活动所必需的。而其他类型的非编码RNA,大部分更偏重于调控性的功能。如果非要比较它和蛋白质谁更重要,蛋白质的功能会更关键一些,但是非编码RNA的参与及功能调控不可缺少。
值得强调的是,非编码RNA在发挥功能的过程中常常是和蛋白质密不可分的,它们的合成就依赖蛋白质,也需要和蛋白质相互作用形成复合物,才能折叠成具有功能的构象,进而发挥生物学功能。另一方面,许多蛋白质同样要依赖非编码RNA作为其“分子伴侣”“脚手架”“适配体”等发挥功能。
RNA的折叠比蛋白质简单吗?
不,我认为和蛋白质相比,RNA的结构更加复杂多样和多变。
蛋白质的折叠大致遵循安芬森法则(Anfinsen's rule),也就是蛋白质折叠的热力学猜想:一级序列决定三维结构,三维结构决定功能。而单链的RNA,尤其是长的单链RNA,它的柔性非常强,单独存在就很容易打结(形成knots),较难形成功能性的折叠构象。所以在细胞中,它就需要和不同的蛋白质以及其他生物分子相互作用,在它们的帮助下完成折叠。而且在RNA合成和发挥功能的不同阶段,它还会和不同的分子相互作用、形成不同的构象。也就是说,RNA的折叠不只取决于它的序列本身,而是需要更多维地考虑细胞中的其他分子。这就意味着在当前的知识框架下,还没有一个简单的理论能够概括RNA的折叠机制,因而很难对RNA的结构进行准确预测。
对于lncRNA,我们已经有比较深入和完整的认识了吗?
lncRNA的种类非常多,参与各种生命活动。同时这个领域的研究也很难,可以说,直到目前为止,我们对lncRNA还缺乏规律性的认知。举例来讲,在20世纪90年代初,人们发现了一个非常重要的lncRNA,叫作Xist,它在哺乳动物雌性性染色体的随机失活过程中发挥着非常关键的作用,因此也吸引了许多研究者的关注。甚至可以说,在2005年Tiling Array出现以前,是这一个RNA撑起了整个lncRNA研究领域。然而直到现在,三十多年过去了,围绕Xist发挥功能的机制,学界仍然有许多争论。
LncRNA非常多样,有些只需要数百个碱基就可以发挥功能,而另一些则可以长达3.6万个碱基——Xist就很长,有2.1万碱基。如此长的lncRNA要发挥功能,可能是依赖于其中一些功能性的单元模块从而与一些功能因子互作,但是这些关键单元如何形成、如何折叠、如何与蛋白质相互作用,目前还没有发现一个普适性的规律。
具体到环形RNA,它和线性的lncRNA相比又有哪些特点?
RNA成环以后,它的结构就会变得更稳定,因此在细胞中它的降解和合成速率通常都很慢。但是在一些生理或病理条件下,它又可以被快速降解,它们的缓慢生成和快速降解使环形RNA能够作为一个群体发挥调控功能。此外,小于500个核苷酸的短链环形RNA也很容易形成分子内的双链结构,从而折叠为一类特殊结构的分子与蛋白质相互作用,如抑制免疫因子——双链RNA活化的蛋白激酶(PKR),进而参与天然免疫的调控。这些研究提示环形RNA很适合被开发为RNA适配体,有望在生物医药领域应用。
LncRNA和circRNA的研究方法已经成熟了吗?
人们一直在不断拓展RNA的研究方法。目前,蛋白质研究中可以做的免疫沉淀、生物成像、结构解析等手段,在RNA中也可以做,但是相对来讲,还不如蛋白质研究那么便捷,并且精度也尚不能达到蛋白质研究的程度。此外,研究环形RNA还会更难一点,因为研究者需要在细胞中把环形RNA和与它序列相同的线性RNA区分开来,而且在各种实验中,也都需要做好对照——加入同序列线性RNA的对照组。
我认为做RNA研究,一方面要针对你所研究的RNA特性,找到最适合它的研究方法,另一方面也需要跳出现有的研究框架,去探索新的研究方法。
“跳出现有框架的新方法”可能会向哪些方向发展?
首先,因为RNA的结构柔性很高,也时常处于动态之中,所以需要更高的分辨率,更加实时动态地去捕捉它的状态。如何实现?RNA功能研究需要整合跨学科方法,包括RNA化学、RNA生物物理学、基于RNA的细胞生物学等手段,最终目标是在单分子和原子分辨率上解析非编码RNA及其与蛋白质形成的复合物的结构,阐明内在的RNA结构-功能联系。
其次,我们将更加关注RNA在生物体内的真实状态及其与功能分子的互作机制。目前很多研究都是在体外培养的细胞系中进行的,而这可能与生物体内的细胞状态大相径庭。
此外,我们还将更加细致地研究RNA的生理功能。RNA在物种间的保守性并不高,一种RNA可能只在特定的物种体内、在特定的生理病理条件下才能发挥某种特定的功能,这就需要我们在研究中非常小心。因此,未来研究有必要开发合适的动物模型和人类类器官研究体系,用于非编码RNA相关的表型分析、疾病模型和体内治疗潜力等研究。
对于想要投身非编码RNA研究的其他领域研究者,您有什么建议?
非编码RNA与生命活动息息相关,与肿瘤、神经、免疫等很多领域相联系,因此这些领域的研究者也都开始涉足RNA研究或利用RNA研究手段促进相关领域发展。我认为最重要的是,研究者需要知道RNA不是蛋白质,需要认真解析所关注的那个特定的lncRNA特性,例如首先搞清楚它在基因组上的位置、它的生成途径、它的亚细胞定位等基本信息,然后才能选择适合它的研究方法,从而得到可信的研究结果。比如说,如果关注的lncRNA定位在细胞核中,而研究者像敲低蛋白质一样简单地用RNAi技术去敲低它,那么这些小RNA可能根本就不能进入细胞核,得出的实验结论也就很可能是具有误导性的。
临床应用,曙光已现
有一些lncRNA和circRNA已经展现出临床应用前景,能介绍一下这方面的情况吗?
lncRNA和circRNA会参与一些疾病的发生,因此有可能用于这些疾病的诊断和潜在治疗。
作为诊断的生物标志物,一个例子就是我刚刚提到的,利用一种sno-lncRNA的缺失,通过优化的PCR等手段,使我们能够在微升血样的水平或者使用干血斑的样品很容易地检测出它们在小胖威利综合征中的缺失,可以作为一种便捷的手段辅助PWS检测。如果后期能够推向临床,甚至可以在新生儿中做常规筛查,将有利于患儿和患儿家庭,因为如果能够早诊断、早干预,通过补充生长激素,患儿是有机会像正常孩子一样生活的。
在疾病治疗方面,有些疾病是由具有调节功能的lncRNA发生异常导致的,所以补充这种RNA就可以产生治疗效果。这种方式甚至不需要补充完整的长非编码RNA,而是将lncRNA中发挥功能的元件 ——可能只有20个核苷酸 —— 做成RNA适配体药物,进行潜在治疗。而且,因为circRNA更加稳定,它要比lncRNA更适合做成适配体。我们研究组近期也在做相关工作,发现circRNA适配体具有治疗PKR过度激活有关的炎症性疾病的潜力。此外,体外合成的有正确折叠构象的环形RNA一般具有低免疫原性,也为下一代RNA药物研发提供新的机遇。
这些年我自己的想法也在不断变化。如果是在五年前,我们研究组做出一个原创发现,可能会侧重考虑发表文章,然后就去研究下一个问题;而现在有了一个发现之后,我会进一步思考,想一想这个发现可能有怎样的应用,能为人们的健康带来怎样的帮助。为此,我会去寻找合适的合作者,希望他们能够帮我们把这些想法转化为实际应用。
除了专注于基础研究的探索,一些科学家也可以思考原创发现面向应用转化的可能,这样也许可以为研究经费的价值体现提供一个新的出口。
在生物医学成果转化方面,您认为中国目前还需要怎样提高?
我觉得在从科技创新到技术应用的这条路上,我们还缺少各种类型的人才。因为在这个链条上,需要的不只是科学家,还需要政策上的扶持、社会力量的投入,需要经验丰富的、具有生命科学素养的政策对接人和企业运营者。
在过去十年中,中国对非编码RNA这个领域有比较大的投入,也培养了一批人才,我希望这批人不仅能成为RNA研究的中坚力量,也可以成为原创性RNA应用转化的中坚力量,大家一起努力把这个领域越做越好。
女性做科研:逢山开路、遇水搭桥,绝不放弃
科学家应该承担哪些社会责任?您自己会做些什么?
中国科学院认为科学家应该心系国家事、肩扛国家责。我觉得这句话说得特别好。我很开心能生活在一个尊重知识、尊重人才、尊重劳动、尊重创新的时代,让我能够去做自己想做的科研工作,也获得精神上的回馈。
具体到我个人,首先就是要做好科研工作,我现在45岁,我希望自己不要在这里就停滞不前了,而是还能再有新发现、新突破。其次我希望能带好团队,为国家培养相关的人才。作为一个重点实验室的主任,我会努力扶持青年人才,充分利用自己在RNA领域的研究经验,多和他们交流,至少在他们回国初期最需要支持的一段时间里,能为他们提供支持和帮助。此外,我和我的团队还会积极参与科普工作,提高全民尤其是青少年儿童对科研的兴趣和热情,把科研的种子播在他们幼小的心灵上,让他们以成为科学家、从事科学相关的工作为荣。
对于年轻的科研人员,尤其是女性科研人员,您有什么建议?
做科研是一件很美好的事情。因为这是一项追求真理的工作,所以做科研也是一件很酷的事情,同时让我们有机会去体验很不一样的人生。研究的英文叫作research,拆解一下就是re-search,这意味着它是一个曲折的但是会螺旋式上升的过程。所以我希望研究者在任何时候都要坚持,不要放弃,最终一定会有收获。
对于女性科研人员,我有太多话想说。作为一名女性导师,我想对女生们说:不要让你拿到博士学位的那一天成为你职业生涯的终点。在生命科学领域,研究生中女性比男性更多,但是她们中能够坚持科研道路,最终成为教授、研究员的比例非常低。这种差异表明,许多女性科研工作者在职业生涯早期就离开了活跃的学术研究一线。
因此我想呼吁青年的女性科学家,不论多难,只要你喜欢做科研,就一定要坚持。作为女性,我十分理解我们还要承担来自作为母亲、作为子女的社会责任和压力,但在遇到困难的时候,少些抱怨、不怕苦累,积极寻求家人、单位和社会的帮助,着力去解决问题,借助大家的力量帮自己渡过最艰难的阶段。哪怕是在生完孩子的最初两年,确实因没人帮忙而不得不离开,等这两年克服过去,还可以重回岗位。一定不要轻易说“我不干了”,要坚定信念、坚持自我并激励自我,不要轻易掐灭心中的科研火焰。
此外,作为在职业中期的一名女性科研人员,我同样面临着困难和压力——要协调好自己作为团队负责人、作为母亲、作为子女、作为妻子的角色常常并不容易。但是同样的,我们也可以多找渠道来疏解自己的压力,采取更高效的方式,坚持自己对科研的初心。
本文作者赵维杰是《国家科学评论》(NSR)的新闻编辑,本文英文版“Ling-Ling Chen: RNA Has Its Own Features, don't Study It as a Protein”刊载在NSR上
术语对照
lncRNA long non-coding RNA
长非编码RNA
snoRNA small nucleolar RNA
小核仁RNA
sno-lncRNA 含有小核仁RNA的长非编码RNA
SPA RNA 5′snoRNA capped and 3′polyadenylated RNA
5′端有小核仁RNA帽子、3′端有多聚腺苷酸尾巴的RNA
circRNA circular RNA
环形RNA
rRNA ribosomal RNA
核糖体RNA
tRNA transfer RNA
转运RNA
snRNA small nuclear RNA
小核RNA
miRNA microRNA
微小RNA
piRNA Piwi-interacting RNA
Piwi相互作用RNA
mRNA messenger RNA
信使RNA
ADAR Adenosine Deaminases Acting on RNA
RNA腺苷脱氨酶