于细胞而言,线粒体可不止是“能量工厂”。
与细菌不同,真核细胞具有膜连接结构,能够将细胞区分为不同的空间并能运行开展不同的工作。这样的“建筑”结构是如何演化而来的正广受热议
约15亿年前,一件影响深远的重大事件发生了:两个小小的原始细胞合二为一。这一融合从根本上改变了我们星球的演化进程,其影响程度也许超越了除生命诞生以外的任何事件。
一枚细胞进入另一枚细胞并留于其内,最终演化为线粒体——一个连小学生都会学习并知晓是“细胞的能量工厂”的结构。这一新结构为其宿主提供了巨大的能量优势,即为后来复杂的多细胞生命演化提供了先决条件。
但这只是故事的一隅。在错综复杂的真核细胞内,线粒体并不是唯一重要的结构。除了线粒体,真核细胞内还存在着与细胞膜相连的基因组安全卫士——细胞核,以及完整的、对于细胞内及其周围蛋白质和其他物质的生产、运输和回收至关重要的内膜系统——内质网、高尔基体、溶酶体、过氧化物酶体和液泡。
所有这些结构源起何处呢?随着所发生的一切遗失在遥远的过去,鲜有痕迹留存下来能作为演化的线索,因此,这个疑问极难解答。
研究人员曾提出过各种假设,但直到最近,靠着新工具和新技术,细胞生物学家才能够探究这种复杂结构的缘起,并揭示其可能的起源。
微生物的融合者
真核生物起源于两枚细胞融合的观点可以追溯到100多年前,但直到20世纪60年代,在已故演化生物学家林恩 · 马古利斯(Lynn Margulis)阐述了她的内共生理论后,这一观点才被人接受并广为人知。马古利斯说,线粒体很可能起源于一类被称为α-变形杆菌的微生物,这一群体品类繁多,其成员包括引发斑疹伤寒的细菌(立克次体)和在植物基因工程担当重任的细菌(农杆菌)。
关于原始宿主细胞的基本特征我们一无所知。有科学家推测,它应该已经相当复杂,并且细胞内已经含有各种膜结构。这样的细胞可能已经具有吞噬和摄取东西的能力——这是一种复杂且耗能的真核细胞特征,被称为吞噬作用。也许这就是线粒体最初进入宿主的方式。
但这个在内共生起源假说中被称为“晚期线粒体模型”的理论并不能解释宿主细胞如何以及为何能在融合之前就变得如此复杂。
2016年,德国杜塞尔多夫大学的演化生物学家比尔 · 马丁(Bill Martin)、细胞生物学家斯文 · 古尔德(Sven Gould)和生物信息学家斯里拉姆 · 加格(Sriram Garg)提出了一个迥异的模型,即大家所知的 “早期线粒体模型”假说。他们认为,当今没有任何存世的原始细胞是具备内膜结构的,这样看来,15 亿年前的细胞似乎也不太可能会拥有这些结构。
与之相对的,科学家解释道,内膜系统,这个如今在内容复杂的细胞内能找到的所有配件大杂烩可能是在α-变形菌在一个结构相对简单的宿主细胞(一种古菌类的细胞)内安顿下来的不久之后演化形成的。膜结构有可能诞生自线粒体祖先释放出来的气泡或者囊泡。
自由生活的细菌一直出于各种原因,不断地有囊泡脱落,古尔德等人备注道,因此认为细菌在被包裹进宿主细胞内后还会继续这样做是顺理成章的想法。
最终,这些囊泡变得具备专门执行如今在真核细胞内膜结构所具有的功能,甚至还与宿主细胞膜相融合,这能有助于解释为什么真核细胞质膜还会具备细菌特征的脂质。
阿姆斯特丹大学的生物化学家戴夫 · 斯佩耶尔(Dave Speijer)表示,囊泡可能承担了重要的初始功能。新的内共生体可能通过氧化并燃烧脂肪酸以获取能量,并产生大量被称为“活性氧”的有毒化学物质。“这些物质会破坏一切,它们是有毒的,尤其在细胞内部更甚,”斯佩耶尔说,“将这些物质隔绝在囊泡内能帮助细胞免受伤害。”
新房客制造的另一个麻烦也可以通过构建膜屏障来加以解决,古尔德等人补充道。在α-变形菌进入宿主细胞内后,其DNA片段可能会与宿主古菌的基因组相混合,即插入到宿主细胞重要的基因之中使之中断。要修复这个问题就意味着演化出能够将这些外来片段(如今这些片段被称作内含子)从信使RNA(mRNA)上拷贝出来的基因副本中剪掉的机制功能,这样一来制造蛋白质的指令才不会出现乱码。
但这又制造出了另一个麻烦。蛋白质合成机——核糖体——运转速度极快,是以秒为单位将多个氨基酸连接在一起。对比之下,细胞的内含子清除系统则很慢,是以分钟为单位摘掉一个内含子。因此,除非细胞能够让mRNA在被正确加工之前都能与核糖体保持距离,否则细胞就会生产出许多无意义且无用的蛋白质。
包围在细胞核周围的膜结构为这个麻烦提供了答案。作为区分空间的屏障,细胞膜允许mRNA在细胞核内完成剪接,然后无内含子的mRNA在细胞内的液体空间(细胞质)中进行翻译。“这是细胞核起源背后的选择压力”,马丁评论道。为了形成这样的结构,内共生体分泌的囊泡需要平展开来再包裹住基因组,从而形成能将核糖体隔绝在外又能允许小分子自由通行的屏障。
由内向外的解释
简而言之,古尔德等人的早期线粒体模型解释了内膜区室演化的原因:为了解决新房客带来的问题。但欧洲分子生物学实验室(EMBL)的细胞生物学家高顿 · 戴伊(Gautam Dey)指出,这一假设并不能完全解释α-变形菌最初是如何进入宿主体内的,因为假设默认内共生体已经在宿主细胞内部。“这是个大问题。”戴伊说。
另一种观点则是“由内向外模型”假说,是由曾与戴伊共事过的伦敦大学学院细胞生物学家巴兹 · 鲍姆(Buzz Baum)及其堂弟、威斯康星大学演化生物学家大卫 · 鲍姆(David Baum)于2014年提出的。在该理论创设的情境中,α-变形菌和最终注定会成为其宿主的古菌细胞互相依赖对方的代谢产物,以一种亲密无间的共生关系比邻共存数百万年。
古菌细胞上可能生有长突起,就像在当今存世的、与其他微生物紧密共生的古菌(阿斯加德古菌)细胞上所观察到的一样。α-变形菌会依偎在这细长的外延体之上。
最终,这些突起物会将α-变形菌包围并完全将其裹入内部。但在这最终发生之前的漫长时间内,古菌细胞可能已经开始执行某种空间分工:将信息处理工作留在基因组所在的中心区域,而让蛋白质构建等功能在突起内的细胞质中进行。
鲍姆说,由内向外模型的有力之处在于在α-变形菌完全被封闭之前,它给了细胞亿万年的时间用以演化出能对终将全然内化的线粒体和其他膜室的数量及大小进行调控的机制。“如果不能对这些调控,那就死定了。”鲍姆评价说。
这一理论模型还解释了为什么细胞核拥有如今这样的形状,尤其是对其大得超乎寻常的核孔提供了阐释。鲍姆说,从古菌细胞的中心内部去观察,这些长突起看上去就像是开口,这些开口最终可以自然形成巨大如斯的孔洞。
最重要的是,由内向外模型解释了一开始α-变形菌是如何进入古菌宿主内部的。
尽管如此,由内向外模型仍有需要解释清楚的地方。举例来说,由于古菌突起环绕包围,线粒体最终可能会出现在错误的地方——内质网内部,而这里是坐落了细胞内负责制造蛋白质的核糖体的管道网络。由此就需要有额外的步骤来让α-变形菌进入到细胞质。
但马丁主要反对的是,由内向外模型并没有提供一种会导致细胞核或者其他膜连接组件需要一开始出现的进化压力。马丁评论说,由内向外模型“是上下颠倒和前后相反的”。
细胞核:中央的谜语
尽管这些模型都一致同意,认为线粒体是从α-变形菌演化而来的,但它们对细胞核及其他细胞器的起源却有着截然不同的看法。
在古尔德等人的早期线粒体模型中,所有结构的起源都来自演化中的线粒体所释放的囊泡。含有反应性化学物质或细胞货物的囊泡以及能搬运这些货物的能力会很早就演化出来了,而细胞核则会迟一点出现。
在由内向外模型中,细胞核本质上是古菌细胞用膜包裹在α-变形菌周围后所形成的剩余结构,所以细胞核会立刻出现。内质网也可能很早就形成,因为这是由那些被挤压在一起的突起所形成的。鲍姆说,其他细胞器是从古菌细胞膜上的芽结构中产生,出现的时间会更晚。
由此,这些模型还会对细胞器膜结构的化学性质(至少最初的性质)产生不同的预测,以及如今复杂的细胞如何会拥有化学性质与细菌而非古菌相似的膜脂。
在古尔德等人的模型中,除了宿主细胞的最外层膜结构,所有的膜结构都会与新房客的膜结构一样是细菌源性的。此后,随着细菌源性囊泡与古菌外膜融合,细菌源性脂质会逐渐替代古菌源性脂质。
在由内向外模型中,细胞核和内质网(也许还有其他结构)的膜一开始与宿主细胞相同,是古菌源性的。只是后来在细菌基因组的基因转移到古菌基因组后,脂质本质上才会变成细菌源性的,鲍姆解释道。
怎样检验这些想法呢?细胞生物学家通过实验,开始窥到简单囊泡分化为肩负不同职责的细胞器的机制真容:分化可以通过呈现不同的形状,就像现在细胞的内质网或者高尔基体层层堆叠的膜结构;或者是通过最终在其内部或者其膜结构上留有不同的蛋白质。
他们还总结出了现代线粒体动力学要点以及突出了其产生新膜结构的潜力。举例来说,斯佩耶尔认为早期演化的细胞区室是为了处理细胞内的活性氧物质——过氧化物酶体。
2017年,蒙特利尔麦吉尔大学的细胞生物学家海蒂 · 麦克布莱德(Heidi McBride)报告称,缺乏过氧化物酶体的细胞可以从头生产出来。通过研究不具有过氧化物酶体的突变人成纤维细胞,她的团队发现,这些细胞会将一些蛋白质放入线粒体中,这些蛋白质对于过氧化物酶体运行其功能不可或缺,随后线粒体膜将这些蛋白质以小气泡或囊泡的形态将其释放出去。
当这些囊泡,又称过氧化物酶原体,与另一种源自内质网的囊泡融合时,它们就会成熟为真正的过氧化物酶体,后者携带着过氧化物酶体必需的第三种蛋白质。“这是一种杂交混合细胞器。”麦克布莱德说。
对于麦克布莱德而言,这表明过氧化物酶体——可能还有其他细胞器——最初来自线粒体(而并不像以前大家认为的那样完全来自内质网)。“线粒体的存在启动了新细胞器的生物发生,”她说,“就过氧化物酶体而言,这相当直接的。”
线粒体其他奇怪的小动作也已被科学家注意到了。
一开始,犹他大学生物化学家亚当 · 休斯(Adam Hughes)实验室在2021年发布的一份报告显示,他们发现,当酵母细胞被喂食了达到致毒水平量的氨基酸时,它们的线粒体会脱落载有转运蛋白分子的囊泡。转运蛋白会将氨基酸搬进到囊泡中,让它们不会毒害线粒体。
休斯还发现,线粒体脱落的囊泡可以形成多层长管状延伸体,这让人不禁联想到内质网和高尔基体的多层堆叠结构。这些结构在细胞中已经存在了很长时间。“它们绝对是自身独有的结构。”休斯说。
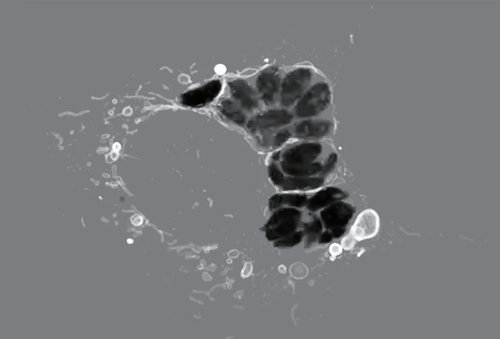
后来,加州大学洛杉矶分校的免疫学家雷娜 · 佩尔纳斯(Lena Pernas)在2022 年证实,线粒体衍生出的多层结构也可以在其他环境中形成。她的团队发现,当细胞被寄生虫弓形虫感染时,线粒体会包围寄生虫并改变形状。寄生虫对此做出反应,最终的结果是线粒体会脱落大量外膜。
佩尔纳斯曾在《生理学2016年年度综述》(the Annual Review of Physiology in 2016)中撰写过关于线粒体重塑的文章,最近她发现,这些乍看之下如简单囊泡的结构也可以生长并呈现出更复杂的形状,如堆叠的片状层结构。更重要的是,感染应激会改变这些在脱落的线粒体膜上安置的蛋白质类型。佩尔纳斯说,这些变化为这些堆叠的层状结构打开了一扇大门,让它们能够有不同于以往的表现,为它们承担新工作提供了机会。
这张显微图像显示了寄生虫弓形虫(黑色)感染小鼠细胞时细胞会发生什么。细胞的线粒体(白色)会聚集在入侵者周围,并开始脱落由线粒体外膜生成的囊泡(白色气泡)。有时,囊泡可以形成复杂的多层结构。此类观察揭示了在真核生物演化过程中,各种内膜结构可能在早期演化的一种方式
这些结构本来是在全然不同的细胞内和条件下发现的,然而佩尔纳斯和休斯对它们研究得越多,就发现它们看起来越相似。休斯说,这样的结构是如何在真核生物演化的早期形成的,又是如何能够经过亿万年的自然选择,演化成当今细胞中存在的这样的内膜区室结构,光是想象一下都撩人心弦。
我们也许永远不可能确切地知道很久以前到底发生了什么,但通过探索当今存世的细菌、古菌和真核细胞中可能发生的一切,科学家可以更清楚地了解什么是可能的——甚至是极有可能发生的事情。一枚细胞进入另一枚细胞,带来了益处,也带来了问题,这些引发了复杂的级联反应。此后,正如麦克布莱德说:“所有这些东西终会开花结果。”
资料来源 Knowable Magazine