[提要] 最近,在研究经肌醇脂类而产生细胞内信号的受体方面进展迅速。这些脂类之一的4,5 - 二磷酸磷脂酰肌醇被水解成二酯酰甘油和三磷酸肌醇,构成了控制包括分泌、代谢、光转换和细胞增殖在内的各种细胞活动的信号转换机制的一部分。二酯酰甘油在膜平面内起作用以激活蛋白激酶C,而三磷酸肌醇则释放到细胞质内作为动员细胞内钙的第二信使。
细胞的行为都是由信号系统控制的,此系统把外界信息转变成特定的内部信号——第二信使。细胞表面受体起着分子天线的作用,接收外界信息(如激素、生长因子、神经递质或光),这些信息被转换和放大成第二信使,从而控制着细胞的各种活动。
以cAMP作为第二信使的信号系统是众所周知的。但直到最近,我们才对另一种主要信号通道的第二信使的本质有所了解,这种通道有一部分是以肌醇脂类作为转换机制的。在许多不同类型的细胞中,肌醇脂类的增强了的代谢是对各种外界信号的应答。Durell等提出这一增强了的代谢可能是受体功能的一部分,随后,Michell认为肌醇磷脂的代谢与那些升高细胞内钙的激动剂的作用方式有关,尽管这一假说还未全部被广泛接受,但许多现象,如钙动员激动剂与受到激动的肌醇磷脂的转换以及许多阴性对照(非动员钙的受体不能促进肌醇磷脂的分解代谢)使人们广泛承认钙和肌醇磷脂之间是紧密联系的。现已清楚,当受到刺激后,许多不同的细胞包括卵母细胞、胰岛细胞、腮腺、垂体GH3细胞、血小板等,其活化钙的一个重要来源是从细胞内储备中动员钙。所以,不仅在钙和肌醇之间,而且在质膜(有关受体所在处)和钙的内储备之间有一个中间环节未被认识。我们的假说是:三磷酸肌醇(InsP3)就是这一中间环节。
三磷酸肌醇的生成
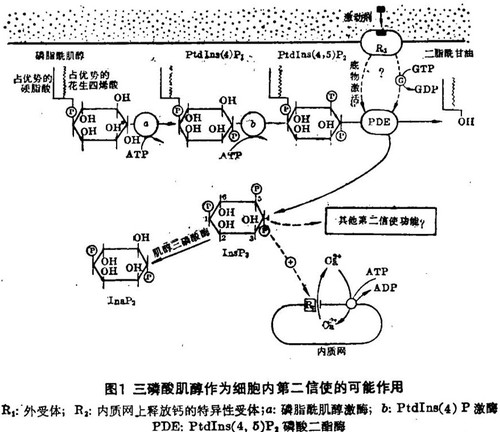
4,5-二磷酸磷脂酰肌醇(PtdIns(4,5)P2)是位于质膜内表面的肌醇脂类的一种,它是通过两步磷酸化而生成的;先是通过特异性激酶在肌醇骨架环的4'位上磷酸化而生成4 - 磷酸磷脂酰肌醇(PtdIns(4)P),然后再在5'位上磷酸化生成PtdIns(4,5)P2,这即为受体系统作用的直接前体。正如有两种激酶逐步把磷脂酰肌醇磷酸化成PtdIns(4,5)P2,也有相应的磷酸单酯酶催化上述反应的逆过程。这些激酶和磷酸单酯酶构成了两个相连的磷脂酰肌醇/ PtdIns(4,5)P2无效循环:在肌醇骨架环的4'位和5'位上不断地加上又除去磷酸基。这种无效循环在代谢上是很不经济的,这也许可解释为什么代谢抑制剂能迅速阻断这一信号转换机制的活动,当一激动剂占领受体后,就使PtdIns(4,5)P2跳出此无效循环,经磷酸二酯酶(磷脂酶C)作用 · 后降解成InsP2和Sn-1,2 - 二酯酰甘油(图1)。
在用加压素刺激肝细胞后,发现其PtdIns(4,5)P2的下降先于磷脂酰肌醇的改变,而且这一改变与细胞外的钙完全无关,这一重大进展改变了我们以往的肌醇磷脂代谢及功能的概念。受体受刺激后的原发性反应可能是把PtdIns(4,5)P2水解成Sn-1,2 - 二脂肤甘油及水溶性的InsP3。目前很多研究都支持这样一种观点:许多不同类型的细胞对外界各种刺激的共同反应是水解PtdIns(4,5)P2。在丽蝇唾液腺和克隆化的GH3垂体细胞里,InsP3的生成先于一磷酸肌醇(磷脂酰肌醇水解的预期产物)的生成,这一发现为PtdIns(4,5)P2是受体的原初底物提供了又一个证据。更重要的是,当受到5 - 羟色胺的刺激后,InsP3在丽蝇唾液腺中几乎是立即就生成的,而钙依赖性生理学反应的起始至少要迟一秒。这就提示InsP3是钙动员的第二信使。
InsP3和二酯酰甘油生成的一个尚未解决的问题是,受体与PtdIns(4,5)P2磷酸二酯酶是怎样偶联的。最近有人报告,在分离的膜中加压素能促进PtdIns(4,5)P2的裂解,这可能有助于阐明转换机制。激动剂可诱导受体的构象发生改变,接着膜也发生了充分的改变以使PtdIns(4,5)P2更易为磷酸二酯酶所作用。如同受体与腺苷酸环化酶的联系一样,PtdIns(4,5)P2磷酸二酶也可能是通过鸟苷三磷酸(GTP)结合蛋白使受体与酶偶联的机制而得以控制的。
第一个表明GTP结合蛋白可能在钙动员受体的信号转换中行使功能的迹象是,GTP能降低去甲肾上腺素与α1受体、碳酰胆碱与毒蕈碱受体之间的亲和力。对于肾上腺素能受体,百日咳毒素通过抑制腺苷酸环化酶而降低GTP对α2受体的调节作用,但对动员钙的α1受体却毫无作用。这就提示这两种受体是通过不同的GTP结合蛋白来调节的。
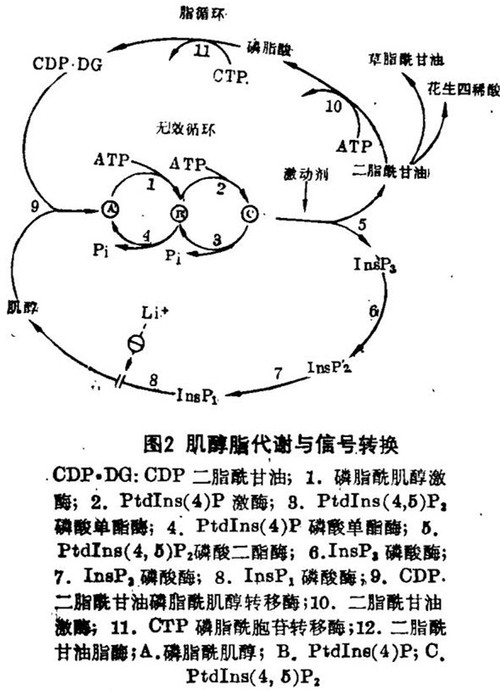
另外,ras癌基因的产物P21是一种与膜结合的蛋白。能够结合并水解GTP,可能像假设的GTP结合蛋白那样起作用以把受体与PtdIns(4,5)P2磷酸二酯酶联系起来。与此观点相吻合的是,已发现上皮生长因子(EGF)能增加GTP与rasP21的结合,这就提示ras基因的产物能与细胞表面受体相互作用。所以,GTP结合蛋白在控制cAMP产生中的全面的作用应进一步扩展,以包括对诸如通过这些钙动员受体而生成IdsP3等其他转换机制的控制(图2)。
三磷酸肌醇的去除
细胞内二酯酰甘油和InsP3的水平由它们从PtdIns(4,5)P2生成的速率与通过两条途径使其回到磷脂酰肌醇的消除速率之间的平衡所决定的(见图2)。磷酸肌醇循环以肌醇三磷酸酶为起点,后者水解5'位上的磷酸生成1,4 - 二磷酸肌醇(InsP2)从而削弱InsP3的第二信使活性。肌醇二磷酸酶水解InsP2生成1-磷酸肌醇(InsP1)。除了1-磷酸肌醇外,脑提取物中也含有相当量的4-磷酸肌醇,这提示磷酸二酯酶可能并非是绝对特异的,或者存在有两种不同的酶。锂可通过阻断磷酸肌醇循环而纯化受体,以减少受体作用过程中所需的肌醇脂类的供应。
总之,有四个生化循环与肌醇脂类在信号转换中的作用有关(图2):脂循环和磷酸肌醇循环最终汇合以合成磷脂酰肌醇,后者进入磷脂酰肌醇/ PtdIns(4,5)P2无效循环。转换机制中的关键步骤是磷酸二酯醇水解PtdIns(4,5)P2,它代表了皆作为第二信使的两种产物——二酯酰甘油和InsP3在信号通道中的分叉点。
钙动员
InsP3钙动员假说的证据是通过研究这一推定的第二倍使对各种通透化细胞(InsP3能进入到细胞内钙储备中)的作用而得到的。InsP3的动员钙的性质首次在低钙孵育通透化的大鼠胰腺泡细胞制品中证实。
当通透化胰岛素瘤细胞在低钙介质(1.7 μM)中与ATP共同孵育时,开始分离钙。当环境钙浓度达到0.1 μM的平衡值时,此作用迅速降低,因这一临界值时内储备钙的摄取和释放达到完全平衡。加入InsP3达到2.5 μM的终末浓度时,引起相对于原来平衡点时的钙的快速释放及随后较缓慢的再摄取。再次加入InsP3也得到相似的结果,提示InsP3敏感的钙池在再摄取相时重新充满。在通透化肝细胞中也得到同样的结果:InsP3的降解与钙的再摄取是一致的。
细胞内钙储备似乎由一个囊泡池组成,用排空储备钙而取消InsP3作用的离子载体A23187和离子霉素已证实了这一点。作为钙池可能性最大的是内质网。
激动剂引起的细胞内钙的改变可能是不均匀的,可能位于由表面受体和细胞内钙储备的对合所决定的特异区域内。类似的情况也存在于心肌中,钙据认为是从肌浆网的整个表面摄取的,而仅从靠近T管的终末腔中释放。
以往对完整的肝脏的研究提示,激素依赖的钙动员涉及一个放大步骤,因为相对于通过受体机制而水解的每一个PtdIns(4,5)P2分子要释放十个以上的钙离子。有一种放大步骤可能就发生在内质网平上。目前已有的证据倾向于这样一种观点:InsP3通过促进钙的流出而不是抑制钙的摄取起作用。当加入钒酸盐或除去ATP而使钙摄取完全被阻断时,可见有比加入InsP3缓慢得多的逐渐的钙释放。更进一步,阻断钙摄取,InsP3钙动员的效应可极大地增强。
光转换
光受体起一个转换器的功能,把光能转变成电信号,后者即为视觉信息被送往大脑。光转换过程中,在视紫质捕获光子与离子通透性改变从而启动电活动之间有一个环节还未被我们所认识。一个光子可打开鲎光受体上大约1000个钠通道,这强烈提示光转换中需要有一个第二信使。用3H标记肌醇,发现光引起作为前体的PtdIns(4,5)P2的量的降低,而标记的InsP3的量却相应地增高,这就证实InsP3是光转换的中间环节。章鱼的光受体具有一种蛋白质,其GTP结合与水解功能是对光敏感的。如上述所述,此GTP结合蛋白可能就是激活了的受体(漂白的视紫质)与产生InsP3的PtdIns(4,5)P2磷酸二酯酶的偶联剂。
把InsP3注射入鲎腹侧光受体中,它能像光一样诱导电活动。像作为光转换的第二信使一样,InsP3也可能参与适应过程。把InsP3注入光受体,可降低其对于闪光的反应性。反之,闪光可降低由重复注射InsP3而诱导的反应性。由于在适应过程中涉及细胞内钙的增加,故有理由认为InsP3在光受体中的某些作用,是借助于从内储备中动员钙而实现的。
细胞生长和癌基因
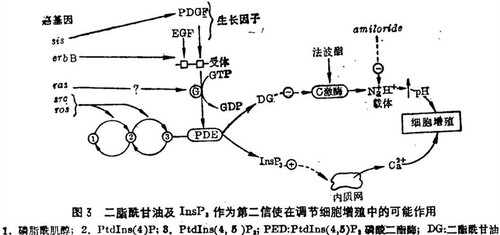
发现InsP3作为一个细胞内第二信使将有助于我们认识依赖于从细胞内储备中动员钙的细胞生长和发育,以往已经知道生长因子可引起肌醇脂代谢的改变,但在质膜和细胞增殖启动之间的一系列事件还不清楚。现有许多人支持这样一种观点:二酯酰甘油和InsP3都可作为控制细胞增殖过程中两种主要离子变化的第二信使(图3)。二酯酰甘油作用于膜的水平上以激活蛋白激酶C,后者可能是肿瘤促进剂法波酯的作用对象。由于法波酯可激活Na+/H+交换载体,已有人提出二酯酰甘油也可能以同样的方式来增高胞浆的pH。这种pH的增加是生长因子作用的特征,并据认为在刺激细胞生长方面有重要作用。
人们早已认识到钙参与细胞增殖。当细胞受精或受生长因子刺激以后,细胞内钙的增加可能依赖于PtdIns(4,5)P2水解生成InsP3,后者使钙从细胞内储备中释放出来。已有实验证明,海胆卵受精以后,其多磷酸肌醇代谢的大大加强是参与钙动员的。把InsP3(但不是InsP2)注射入海胆及海星的卵母细胞内,可发动某些受精过程中的起始事件,这为InsP3的作用提供了直接证据。生长因子作用于瑞士3T3细胞后,导致二酯酰甘油和InsP3生长的增加。因InsP3能使通透化瑞士3T3细胞释放钙,故它可能作为生长因子钙动员作用的第二信使。因此,生长因子诱导的PtdIns(4,5)P2的水解导致了两个信号通道的激活,从而可调节细胞增殖中的两个关键的离子活动。pH的升高可能由二酯酰甘油控制;而钙的水平,则由InsP3控制。
与以肌醇脂类为基础的这一分支信号通道相联系的酶促反应可能代表着某些癌基因作用的部位。与产生PDGF有关的sis癌基因,已知能促进肌醇酯的代谢。erb-B基因编码截去一段的表皮生长因子(EGF)受体(在成纤维细胞EGF促进胞浆游离钙的迅速增高)。src和ros癌基因编码的蛋白可能通过受体机制行使肌醇脂激酶的功能,把磷脂酰脂醇转变成PtdIns(4,5)P2。有理由推测,其他功能尚不清楚的癌基因,可能是编码与此分支信号通道其余步骤有关的酶蛋白的。尤为可能的是,活化的ras癌基因通过失控的PtdIns(4,5)P2磷酸二酯酶的激活而转化细胞。正常的ras基因既可结合又可水解GTP,通过第12位密码子的点突变而活化后的癌基因蛋白仍能与GTP结合,尽管其水解此核苷酸的能力大大下降。如果ras确实在受体机制中起作用的话,那么GTPase活性的丧失意味着这个癌基因蛋白将以一种不依赖生长因子的、失控的方式持续激活InsP3和二酯酰甘油的生成。
早期发育
在早期发育时,卵母细胞内离子流的运动可能与分隔细胞组分以建立前 - 后轴有关。在爪蟾卵母细胞内,使用细胞外震动电极已检测到一钙依赖的氯离子流进入动物极。InsP3使钙从细胞内储备中释放出来而打开氯通道,诱导膜去极化,从而使集中在动物极周围的毒蕈碱受体对乙酰胆碱产生应答。把InsP3注射入卵子内,产生一相似于正常由乙酰胆碱诱导的电生理反应。即使没有乙酰胆碱,卵子也常表现出氯传导性的自发的波动,这也许可解释氯离子进入动物极这一现象。这些自发的波动可能由正常是乙酰胆碱释放的同一“通道开放物质”在动物极的短暂的积聚而引起的。这个物质很可能就是InsP3。所以,在动物极InsP3释放的钙的局部积聚可能导致在这一点上的氯的大量内流。因此,通过钙梯度和电场的局部化而分隔细胞质组分,InsP3可能在早期发育建立卵轴时起重要作用。
第二信使的相互作用
虽然有报告说蛋白激酶C可抑制钙运转,但以InsP3和二酯酰甘油作为第二信使的分支受体系统的一个重要性质是:此信号通道的两个侧支有时可协同地相互作用。对协同相互作用的一种解释是,二酯酰甘油敏感的途径可改变钙途径的敏感性,例如,被法波酯激活的蛋白激酶C导致血小板和肾上腺髓质分泌中的钙敏感的大大增强。某些细胞活动,如血小板的分泌和形态改变,可在钙的静止水平不改变的情况下通过C激酶途径而被激活;但若两条途径同时作用则能更有效地激活。另一重要的相互作用是发现激活蛋白激酶C途径可极大地促进PtdIns(4)P和PtdIns(4,5)P2的生成。由此,二酯酰甘油可作为一个正反馈信号以增加受体系统所需的PtdIns(4,5)P2的生成。
环核苷酸与肌醇磷脂间的相互作用是一个相对还未充分开拓但有潜在的激动人心意义的领域。例如,在血小板,cAMP有显著的抑制肌醇脂降解的作用(通常认为是抑制了磷酸二酯酶,但也有可能是由于其对于激酶或磷酸单酯酶的作用,而这些酶控制了PtdIns(4,5)P2的水平)。另据报告,法波酯对激活腺苷酸环化酶的受体的敏感性也有相应的作用(假设其是作为二酯酰甘油的类似物而起作用的)。
发现InsP3作为一种第二倍使给我们提出了比它所回答了的更多的问题。然而,毫无疑问,肌醇磷脂代谢的分支信号转换系统被很多不同的激动剂用作一种独特的机动灵活的信号发生系统。InsP3的关键作用是动员钙,但它的整个代谢特性使其处于执行其他第二信使功能的中心地位。目前已在越来越多的组织内证实了这一点。
[Nature,1981年312卷5992期]