一位分子生物学家因在阐明免疫系统如何制造花样如此众多的抗体研究方面的贡献而被授予诺贝尔奖金
麻省理工学院的利根川(Susumu Tonegawa)因他在阐明机体如何制造如此众多的抵抗疾病所需的抗体研究上的贡献而获得1987年诺贝尔生理学和滕学奖。他的工作帮助解决了长期以来的一个免疫学难题,即抗体的多样性(diversity)问题。美国国立癌症研究所的Thomas Waldmann称这个问题为“过去三十多年来免疫学的卓绝问题”。这个问题涉及到阐明机体的细胞可能具有充足的遗传信息,它们如何制造基本上无限的抗体。这些抗体是机体抵抗外源入侵物所需的,这些外源性入侵物都是机体在生命过程中会遇到的,包括致病性细菌和病毒。
70年代中期,在瑞士巴塞尔免疫学研究所工作的利根川证明了许多抗体多样性是冉于从三到四个分开的DNA片段中将编码抗体蛋白质的基因进行组装而造成的。Waldannn解释说;“利根川发现了某些史无前例的东西。一个个体能够通过DNA重排制造这样大量的组装分子,就像用A、B、C等基本的字母去组成单词的方式一样”。
多少年来,免疫学家围绕着解释抗体多样性的两种不同的学说争论不休。“种系”学说(germline theory)认为所有制造抗体蛋白必需的基因在种质细胞(精子或卵细胞)中已经形成。问题是基因组大小有限,不能包含所有该学说所预示的这样大爱的基因,以及构成一个动物所需的其它所有基因。
与此相反,“体细胞突变”学说(“somatic mutation”theory)认为仅仅只存在有限数量的基因,但在抗体形成细胞向产生大量多样化抗体细胞发育过程中,这些基因很容易发生突变。
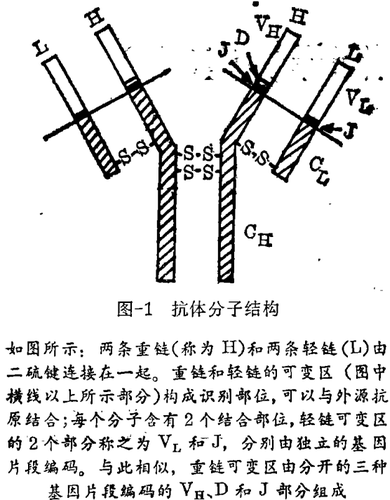
1965年,加州理工学院的Willian Dreyer,和阿拉巴马医学院的J. C. Bennett提出了一种编码抗体分子的方式,该方式可以减少所需的DNA量。一个完整的抗体分子包含有2条蛋白重链和2条较小的轻链。通过分析这些蛋白质的氨基酸序列,发现每一条链可以再分为一个恒定区,该区在一个特定类型的所有链中都是相同的;还有一个可变区,该区在不同的链中都不相同。重链和轻链的再变区结合起来从而形成抗体识别和结合外源性抗原的部分。
Dreyer和Bennett的假说可以简称为抗体合成的“两基因 - 多肽理论”。它认为 - 一个给定抗体蛋白的可变区和恒定区可能由分开的DNA片段编码,这些DNA片段又可连接到一起。尽管对于每一抗体链可能存在许多可变基因,但以这种方式形成抗体可能只需要一拷贝的恒定区基因。
1976年,利根川和巴塞尔的同事Nobumichi Hozumi报道了第一个直接证据:一个抗体轻链的可变区和恒定区是分开编码的,然后结合到一起。这与Dreyer和Bennett的假设一致。利根川和Hozumi检测了来自小鼠胚胎的DNA和来自一株产生抗体的小鼠B淋巴细胞性肿瘤细胞系的DNA。他们发现编码抗体蛋白质的可变区和恒定区基因在胚胎DNA上分开的距离远较在抗体形成细胞的DNA上分开的距离大。哈佛医学院的Philip Leder说:“这一实验证明了基因经历了重排。”
有关抗体多样性问题的研究大大借助于70年代新发展的一些技术,这些技术使人们能克隆基因,测定它的核苷酸序列。利根川与哈佛大学的Walter Gilbert和Allan Maxan*合作测定了来自肿瘤细胞轻链基因序列。所得结果令人惊奇。尽管利根川和Hozumi原先的实验已提示可变区和恒定区基因片段(分别称之为V和C)在肿瘤细胞中已联接到一起,然而序列分析得到的数据表明这两个基因片段仍由1250 bp DNA所隔开,后者并不编码轻链蛋白。利根川说:“V和C非常靠近”,“但它们并不是连续的”。
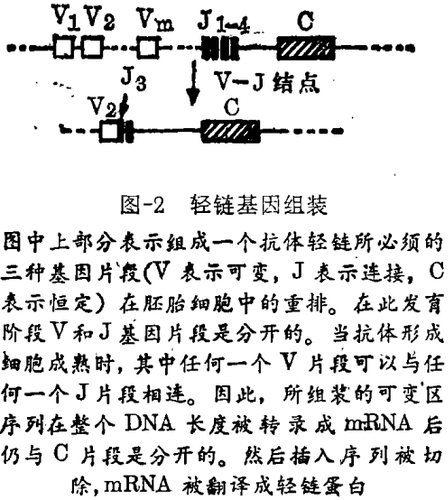
抗体基因是首次证明由非编码DNA序列隔开的基因之一。研究人员不久知道,这些序列为内含子(intron)。正如它们的称呼一样,它们是高等生物基因的一个普遍特性。当利根川和同事们测定一个含有轻链可变区基因的胚胎DNA片段时,他们发现了第二个惊奇的结果:V区基因在编码抗体蛋白的第98位氨基酸后终止。可变区含有大约110个氨基酸,因此该基因太短而不能编码完整的可变区。
Leder当时在国立儿童卫生及人类发育研究所(NICHHD);他和他的同事们已测定了另一轻链可变区基因序列,发现丢掉了一个编码可变区13个氨基酸的基因片段。这提示存在这样的可能性:可能需要2个分开的DNA片段编码一个轻链可变区。通过比较几位研究者,包括Leroy Hood(加州理工学院)、Martin Weigert(Fox Chase癌症研究所)测定的轻链氨基酸序列获得了支持该可能性的另外证据。不久利根川和他的同事找到了丢失的DNA片段,将其称为“J”,意为连接区。在胚胎DNA,它位于恒定区基因开始部位的前面1250 bp——刚好为成熟抗体形成细胞中基因的内含子长度。利根川解释说:“J序列位于C区的上游”,“那么我们能重建在V-J连接时所发生的过程。”
根据图2所示,在胚胎DNA中V和J之间分开很远。在一个抗体生成B细胞向形成一个完整的编码轻链可变区序列的成熟过程中,V和J可以连接到一起。然而,这一编码序列仍与恒定区由内含子相隔开。仅当整个DNA长度被转录成信使RNA后,内含子才被切除掉。
编码抗体重链基因的组装以类似的方式进行。除了利根川小组外,Hood小组也发现了3个分开的DNA片段可以连接到一起而形成一个完整的重链可变区编码序列。第三个编码片段称为D片段,意为多样性(diversity),位于V和J片段之间。
不同的V区基因有数百个可用其去组成不同的重链和轻链,对于大多数抗体链还有数个J,或D和-C基因。既然任何V-J或V-D-J组合是明显可能的#这意味着遗传重排能产生成千上万的轻链和重链。并且,任何轻链又可以与任何重链组合去形成一个抗体分子。因此,所有组合的总数在亿万以上。
此外,尽管V、D和J片段两侧的DNA序列能保证它们进行正确的连接。例如,V只与J而不与另一个V发生连接,但是连接也不总是非常精确的,这一因素又可以引起抗体蛋白发生更大的可变性。最后,Hood和其他人的工作证明在抗体基因中还可发生突变,这是与老的体细胞突变理论相一致。
到80年代初,利根川和其他研究人员的工作揭示了抗体合成的基本原理,表明它是一个完善的系统,该系统中的基因重排、多拷贝基因片段和体细胞突变都与产生抗体的多样性有关。
抗体研究的。一个出乎意料之外的结果r就是提供关于癌形成可能病因的新信息,特别是称为淋巴瘤或白血病的血癌。这搓肿瘤来源于B淋巴细胞和其它的免疫细胞。它们常常出现染色体异常特征。例如:在Burkitt淋其肿瘤细胞来自淋巴细胞。
从大约90%的Burkitt淋巴瘤病人来的淋巴瘤细胞通过8号和14号染色体之间片段的交换而产生异常的染色体。编码抗体重链的基因位于14号染色体,研究人员包括Leder不久知道14号染色体在染色体片段交换过程中其抗体基因中或附近的位点发生断裂。推测发生重链组装过程中DNA重排增加了染色体在该区域的脆性。参与交换后连接的8号染色体片段带有myc基因,它是一种癌基因,暗示能引起肿瘤。推测当它移位时,myc基因的正常调控就失去了,因此,引起肿瘤的发生。编码抗体轻链的基因座位也与Burkitt淋巴瘤细胞中染色体异常有关。
在巴塞尔工作10年后,利根川于1981年转到麻省理工学院。在以后的数年中,他继续探索免疫系统的错综复杂的现象。他的贡献包括发现“增强子”(enhancer)——一个重要的基因调控因素;以及在重链基因的V-D-J和编码区之间的内含子研究方面的发现。
此外,利根川的工作也帮助阐明了T细胞用来识别外来抗原的受体结构,该识别过程是细胞活化所必需的。T细胞的功能活性包括刺激B细胞产生抗体和杀伤病毒感染细胞。T细胞受体蛋白在结构上与抗体根似,它们的基因也由3 ~ 4个分开的DNA片段组装而成。
[Science,1987年10月23日]
——————
* W Gilbert与A. Maxam因合作发明DNA序列快速测定的化学法而被授予诺贝尔奖金——译者注