人类与病毒关系的历史可以追溯到公元前,古埃及第18王朝(公元前1580-1350年)传下的石碑中就描绘了小儿麻痹症患者所特有的瘦小的脚。而在公元前1157年死亡的拉姆塞斯5世木乃伊的皮肤上,也可发现许多天花的“痘疱”。
但是,人类知道病毒存在的事实是在20世纪以后。最初是在18世纪传染病流行时,推断可能有“造成传染的物质”。到19世纪,微生物被确定为“造成传染的元凶,同时各种细菌也相继被发现。从19世纪末到20世纪初,人们知道还有“比细菌更小的病原体,可以通过细菌通不过的过滤器”,因此这种病原体被称为“滤过性病毒”(filterable virus)。1930年,这种病原体又被简称为“病毒”。
于是,“病毒的真面目是什么”便成为公众所关心的话题。大约在20世纪初,有“比细菌小的微生物说”以及“蛋白质说”两种学说。1950年,人类明白了生物的遗传物质是由所谓“核酸”的化学物质组成,病毒绝非单纯的蛋白质,而是核酸与蛋白质结合而成的。核酸有DNA(脱氧核糖核酸)及RNA(核糖核酸)之分。但“一般微生物同时具有DNA及RNA,与此不同的是病毒只含有其中一种而已”,并有其特有的性质,如“必须在活细胞中增殖,增殖方式不像细胞分裂一样的二分法”等。
病毒只是“蛋白质外壳包裹着基因”
生物是由细胞基本单位所组成的,但是病毒并不具有细胞结构。简单来说,病毒是“携带遗传信息的核酸”以及“保护核酸的蛋白质外壳”组成的非常单纯的构造。
一般生物细胞中的核酸均含有DNA与RNA,但是病毒却仅含有“DNA或RNA中的一种”。仅含DNA病毒称为“DNA病毒”,仅含RNA的病毒称为“RNA病毒”。病毒所拥有的蛋白质壳叫做“衣壳”,衣壳(capsid)的外形是正二十面体,看起来是细长筒状。衣壳是由称为“壳粒(capsomere)”的蛋白质基本单元呈规律性地排列所构成的。
让我们来看看典型的病毒形状吧!最简单的是一种仅由衣壳及核酸所组成的病毒,较为人熟知的是引起运动神经麻痹等症状的小儿麻痹病毒以及导致肝炎的早型肝炎病毒等。这些病毒都是在正二十面体的衣壳中挤进RNA的。
还有在二十面体的衣壳外面有称为“封套”(envelope)皮膜的类型,封套原是病毒所感染细胞的细胞膜与核膜,引发口唇疱疹等病毒(herpesvirus)就拥有来自核膜的封套,疱疹病毒的核酸是DNA。
其他的还有以螺旋状结合成衣壳、外侧有封套的病毒。引起麻疹的麻疹病毒以及导致流行性感冒的病毒都属这一类,感冒病毒的核酸是RNA。
病毒的构造很小,所以只有靠电子显微镜才能观察到。大部分病毒生存在以纳米计算的微小世界里;与病毒并列的病原体——细菌,则是生存在以微米计算的世界。
1976年:埃博拉病毒突然出现
1976年6月,苏丹努扎拉镇的一名男性仓库管理员因突然发烧、头痛而入院,后因鼻、口腔与消化道大量出血而死亡。这一事件发生后,又逐渐发现死者周围的人发病,最后情况极为严重,共有284人发病,其中151人丧命。
这是当时完全不了解的病毒所引发的,该病毒以患者最早出现地附近的河川命名,称为“埃博拉病毒”(Ebola virus),所引起的病名全称为“埃博拉出血热”(Ebola hemorrhagic fever)。从1976年到2000年,以非洲大陆撒哈拉沙漠以南为中心,共发生10起,最近一次是在1996年秋天到1997年春天,发生在加蓬共和国。
埃博拉病毒因致死率达到80%而归为“最危险的病原体”(4级),这是由美国疾病控制和预防中心(CDC)所做的结论。日本国家传染病研究所副所长仓田毅博士认为:“虽然是4级,但也没有必要因此而恐慌。”他说:“传染是通过患者的血液、体液扩散的,并没有通过空气传染的例子。传染范围扩大都是由于手套、口罩、长袍、注射器等重要原始的医疗器具不足所引起。只要改善这些情况,就能控制大流行。
埃博拉病毒到底来自何方?病毒原本栖于生物体内,与病毒共存的生物称做“自然寄主”。为了寻找自然寄主,1996年,世界卫生组织在美国陆军微生物研究所与法国巴斯德研究所的协助下,开始进行彻底调查。美国陆军微生物研究所的彼得 · 耶林库博士认为:“蝙蝠可能是自然寄主”。因为与埃博拉病毒同属费拉病毒科(Filoviridae)的马堡病毒(Marburg virus)所引起的出血热,与洞穴中的蝙蝠密切相关。同时埃博拉出血热流行区的山上以及建筑物也发现有许多蝙蝠。但最后的结论未明,研究人员至今仍在寻找病毒的来源。
1981年:艾滋病病毒震撼世界
1981年,医学界权威的《新英格兰医学杂志》刊登了两篇关于症状奇怪的患者的论文,其中一篇是麦肯鲁 · 科德利浦博士的论文“洛杉矶男同性恋间流行卡氏肺囊虫肺炎(pneumocystis carinii pneumonia)及白色含珠菌症”(candidiasis);另一篇是亨利 · 马斯阿博士的论文“纽约男同性恋间流行卡氏肺囊虫肺炎”。

图为艾滋病毒解构图
论文一发表,来自世界各地患卡氏肺囊虫肺炎以及白色念珠菌症、卡波西肉瘤等传染病的患者报告不断提出。专科医师马上掌握了以前很少看到的症状,并认为“这些出现免疫缺乏症状的患者得到了伺机性感染”,而即刻给予“艾滋病”(AIDS,acquired immunodeficiency syndrome;获得性免疫缺乏综合症)的病名。
到1982年时,首次发现使用血液制剂的血友病患者也有同样症状,当时大家认为“通过血液或体液传染的病毒大概是致病因子”。接着在1983年,法国的路克 · 蒙大尼耶博士等人从患者体内发现病毒,3年后将该病毒命名为“人类免疫缺损病毒”(HIV)。人类免疫缺损病毒衣壳中有RNA与名为“反转录酶”的酶,反转录酶的工作是将RNA遗传信息转为DNA。一般生物是以“RNA聚合酶”将DNA信息转为RNA,再利用RNA传送遗传信息。也就是说,反转录酶是朝一般生物相反的方向运送遗传信息。拥有反转录酶的病毒统称为“反转录酶病毒”(ritrocirus)。
人类免疫缺损病毒感染的目标是细胞表面拥有“CD4”(cluster of dif-ferentiation 4)蛋白质的淋巴球。淋巴球是掌管免疫的重要细胞,人类免疫缺损病毒在这种淋巴球中大量增殖。正常淋巴球可以生存很长一段时间,但受到人类免疫缺损病毒感染的淋巴球大约1.5天就死亡。一般人到了100岁也不会出现免疫缺损,主要是因为淋巴球存量很丰富。但是一旦感染人类免疫缺损病毒,免疫系统就无法发挥功能。
目前针对艾滋病的治疗主要靠“阻止反转录酶作用的药物”以及“阻止人类免疫缺损病毒所拥有的蛋白质分解酶药物”并用的方法。
已知5种肝炎都由病毒引起
第二次世界大战时,研究人员注意到肝炎有由水及食物传染的“经口型”,以及通过血液传染的“血清型”两种。经口型称为甲型肝炎,血清型称为乙型肝炎。1965年从澳大利亚原住民血液中得到的乙型肝炎为病毒表面蛋白质的一部分,并首先鉴定出乙型肝炎病毒。
日本国家传染病研究所的宫村达男博士说:“乙型肝炎病毒是非常特别的病毒,虽具有双股DNA,但有一部分则是单股的。病毒的DNA在增殖过程中会并入人类染色体DNA,因此乙型肝炎易转为肝硬化和肝癌,其主要传播途径是输血引起的。
而从患者粪便发现甲型肝炎病毒,则是1973年的事。现在已有优良疫苗,并已知它不会像乙型肝炎一样发展成为慢性疾病而得以治愈。其后又得知两种通过血液感染的肝炎病毒——丙型肝炎及丁型肝炎病毒。丁型肝炎病毒无法自行增殖,一定要与乙型肝炎病毒共存。同时还发现了另一种经口传染的肝炎病毒——戊型肝炎病毒。丙型肝炎病毒转为肝硬化、肝癌的情况很多,是日本最受重视的传染病之一。
近30年出现了20种以上“新兴病毒”
1992年,时任美国疾病控制和预防中心主任的第波特 · 沙佳博士首次使用“emerging and reemerging infectious diseases”的用语,可以翻译成“新兴、再兴传染病”。1993年9月,世界卫生组织与全美科学家协会发表声明:“对新兴、再兴传染病建立全球规模的监测体系是当务之急”。
新出现的病毒被总称为“新兴病毒”。从2000年向前追溯,过去30年间所出现的“新兴病毒”,主要有20种以上。1967年出现的马堡病毒,可能就是新兴病毒的源头。包括已经介绍过的埃博拉病毒、人类免疫缺损病毒以及多种肝炎病毒都是极受重视的“新兴病毒”。
人类自古以来为许多传染病所困绕,但是进入20世纪发明了抗生素以后,因病毒传染死亡的人数就大量减少。1980年世界卫生组织在发表天花病毒已灭绝的宣言后,从那时起,研究人员都认为“传染病的威胁已成过去。”但这是很大的误解。等注意到病毒蔓延时,传染病的散布已相当严重了。
病毒怎样侵入人体细胞
如前所述,病毒只拥有遗传信息、蛋白质壳与膜而已,因此病毒靠自己是无法增殖的,只有寄生于活生物细胞中时才能增殖。细胞中“复制DNA的装置”、“以DNA遗传信息制造蛋白质的装置”,以及“各种生物体材料物质”等都很充分,病毒可将这些物质强行借用。
但是,病毒也并非能自由自在地寄生在任何细胞里。除了一些例外,只有在病毒表面构造的与细胞构造的一部分有着如“钥匙与钥匙孔关系”的情况下,病毒才能抱住细胞,入侵细胞内部。病毒入侵细胞自我增殖,就叫做“细胞感染病毒”。有些病毒仅能感染植物,也有些仅能感染人类,主要的原因就是这种“钥匙与钥匙孔关系”。感染人类的病毒中,有些感染咽喉黏膜细胞,有些寄生在肝脏细胞,也是基于同样理由。
能与病毒结合的寄主细胞表面构造称为“受体”(receptor)。受体有许多种类,有由蛋白质构成的,也有由糖蛋白(glrcoprotein)构成的。一个细胞表面上的受体不止一种,有的病毒与两种不同的受体结合后再侵入细胞内。
与受体结合后的病毒是如何进入细胞中的呢?利用电子显微镜来观察,较为清楚的是托卡病毒科(Togavitidae)阿尔法病毒属(Alphavirus)的病毒。阿尔法病毒为正二十面体衣壳内能容纳RNA、拥有双重脂质层封套的病毒,封套上有许多称为“棘”的蛋白质突起物。
该病毒侵入细胞内时,病毒的棘与寄生细胞膜上的昆布氨酸(laminine)蛋白质受体结合,完成第一步工作。
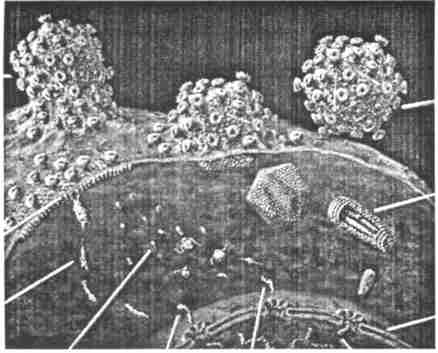
然后,与病毒相结合的细胞膜包住病毒便开始陷没,陷没的细胞膜成为所谓“被覆小泡”(coated vesicls)而进入细胞内。这样一种侵入方法称为胞吞作用(endocytosis)。胞吞作用原本就是一般细胞将各种分子纳入细胞时必要的输送手段,病毒却巧妙地利用了这一方法。
以胞吞作用纳入细胞的阿尔法病毒一旦纳入细胞质内,被覆小泡及衣壳就将其破坏并将其中所藏的RNA释放。放出的RNA被细胞质内的核糖体(ribosome)所捕获,核糖体会根据遗传信息将氨基酸连成蛋白质,其功能就像制造蛋白质的“蛋白质工厂”。
细胞的核糖体原本必须捕获的是细胞本身的RNA,并不知道自己捕获了病毒的RNA,就开始根据病毒的遗传信息制造蛋白质,结果大量的衣壳蛋白质与封套棘部分的蛋白质被制造出来。当然,病毒的RNA本身也大量复制。
此时,合成的衣壳蛋白质集合起来,再次成为正二十面体构造,内部的空间收纳新的RNA。另一方面,合成的棘蛋白质则通过内质网(endoplasmmic reticulum)被输送出去,再交给称为高尔基体(golgiapparatus)的其他胞器。内质网与高尔基体都是蛋白质输送路径重要的胞器,棘在高尔基体中经过加上糖等处理后再被运送到细胞膜。
最后的工作是组成病毒粒子。装入RNA的衣壳向细胞膜附近移动,附有棘的细胞膜被包上衣壳向细胞外突出。此过程叫“出芽”(budding)。出芽的病毒不久就从细胞膜分离。这样,一个细胞就可以大量产生子病毒,其数量可以多达10万个。
人体免疫机制和病毒疫苗
病毒虽可在寄主细胞中大量复制,但我们的身体绝不会让病毒肆无忌惮地破坏。我们的免疫系统一旦认出了体内有异物病毒,就会马上对其进行攻击。
一但病毒开始感染时,免疫系统所采用的攻击方式是分二段进行的。第一阶段的主角是称为“天然杀手细胞”(NK细胞,natoral killer call)的淋巴球与称为干扰素的蛋白质。天然杀手细胞一旦发现感染了病毒的细胞,就将它破坏。另一方面,感染细胞也会分泌出干扰素。干扰素到达未受感染的细胞时,会对未感染的细胞中的RNA分解酶等进行活化。活化的RNA分解酶对侵入细胞内病毒所释放出的RNA可以进行分解,使衣壳与棘的蛋白质制造工作无法进行,于是病毒就不能增殖。另外,干扰素还有提高天然杀手细胞的活性的作用。
在第一阶段攻击进行时,生物体已准备第二阶段的攻击,此时称为“B细胞”的淋巴球制造与此病毒结合的抗体。抗体由称为“免疫球蛋白”的蛋白质组成,抗体呈Y字形,其先端部分与病毒形状相吻合,因此就像病毒表面与受体有钥匙与钥匙孔关系能相互结合一样。病毒表面与抗体先端部分有时也会结合,从而使病毒无法与受体相结合,也不能与细胞膜融合,不可能在细胞内增殖。
B细胞制造抗体之前,必须通过几个步骤。首先是由称为“树状细胞”的细胞以及称为“辅助T细胞”(helpr T cell)的淋巴球提示“侵入病毒的信息”。获得病毒信息的辅助T细胞将B细胞转变成浆细胞(plasma cell),浆细胞再产生抗体。但是抗体对于已感染的细胞不太能发挥作用。因感染细胞会被已活化、称为“杀手T细胞”的淋巴球破坏。活化杀手T细胞的是树状细胞,在杀手T细胞的活化过程中,辅助T细胞也扮演着重要角色。
天然杀手细胞与干扰素的第一个阶段免疫为“非特异性免疫”,抗体与杀手T细胞的第二阶段免疫称为“特异性免疫”。非特异性免疫是无论对哪一种病毒均能作对应的免疫。特异性免疫则是对各种不同病毒的特异性作对应的强力免疫,但是要充分发挥作用是需要时间的。到目前为止,一般认为非特异性免疫与特异性免疫是各自独立作用的系统。但最近的研究发现,非特异性免疫对于特异性免疫的功能扮演着重要的调节角色,两种免疫之间有着密切的关系。
艾滋病疫苗完成了吗?
在特异性免疫阶段,病毒从体内排除之后所留下的是“此一病毒专用”的抗体。此外,一部分T细胞及B细胞保持提供“到底是哪一种病毒侵入”的判断能力。一旦感染了病毒之后,再次感染便较为困难,万一再感染时,病状也可转成轻微。疫苗的制造就是利用这种机制,使生物体“在正式被病毒感染前即先制造抗体,T细胞也可以很快被活化。
目前最期待实用化的疫苗是人类免疫缺损病毒疫苗,但是人类免疫缺损病毒却是疫苗研发非常困难的病毒。人类免疫缺损病毒是将遗传信息由RNA反转录成DNA的特殊病毒,但事实上每次反转录时都有几个地方会复制失误,这样会使合成的蛋白质一点一点地发生改变。而一旦抗体所结合的蛋白质发生改变,就失去了预防感染的作用。如今在美国进入临床试验的艾滋病疫苗是由瓦克斯詹公司开发的“艾滋瓦克”(AIDSVAX)。
该疫苗并不是利用整个人类免疫缺损病毒来制造的,而是将人类免疫缺损病毒基因中制造gp120蛋白质移位于其病毒的最外侧,把容易与抗体结合的部位部分分离,再处理成疫苗。参与该疫苗制造的才田博士说:“无论是哪一种疫苗,医学上绝无百分之百的效果,如果证明感染防御率达到30%,就可以申请专利许可开始制造了。”
目前已知1998年在马来西亚发现的力百病毒是新兴病毒之一,它是从肉用猪通过接触传染给人类的。到1999年4月,马来西亚共有257人得病,其中有100人死亡。目前对于力百病毒尚无有效疫苗及药物防治,防止流行的唯一方法是将感染力百病毒的病区进行隔离,并对所有的猪进行处理。该病毒的自然寄主可能是大蝙蝠。
新病毒的出现也许是人类破坏环境所付出的代价
各种新兴病毒的出现,并非因为病毒自己跑出来侵害人类,而是人类扰乱了病毒巢穴的结果。新兴病毒原本可能以栖息在热带地区森林的猴子、鼠类、蝙蝠等为自然寄主,直到最近,森林深处都是密闭的,因此它们不会出现在我们面前。但是,人口增加及持续干旱,人类为了扩大农田与确保木材的供应而大规模砍伐森林,代价便是我们遭遇到原来封闭在森林深处的病毒。
由于生存环境的变化会持续发生,人类与病毒将一直维持敌对关系。病毒对各种环境的适应力非常强,会随着生态变化发生变异。变异虽然未必朝容易引发疾病的方向前进,但是今后有关病毒的问题会更多。通过密集接种疫苗等措施,小儿麻痹症或麻疹将来可能会绝迹,但感染后在体内继续潜伏的病毒以及以动物为寄主的病毒是无法灭绝的。因此,国家必须做好病毒出现的监视工作、发布警告以及提供正确信息,个人则应该保持警觉。病毒可能在地球上诞生生命时就已存在,这意味着它们是我们生物进化上的同伴。现在,重新摸索与病毒共存之道的时代可能已经来临了。