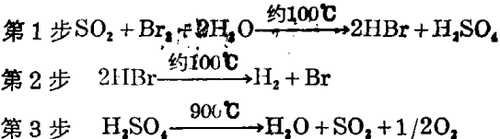矿物燃料和一些替代品
煤、石油、天然气是我们技术上一直依赖的矿物燃料。确实,现代技术发展和矿物燃料的利用相一致,但遗憾的是自然界并不能提供无限的矿物燃料,自然界也不是十分均匀的在全世界分布这些资源。北美和欧洲具有碳氢化合物储量的60%,而这两块大陆分别只有全世界石油总储量的12%和4%,超过一半的石油储量在中东国家,最近的估计指出,大约到2060年全世界的石油贮量将会耗尽,天然气的贮量20年后就将耗尽,这些只是估计,但是一个事实是北美和欧洲将在中东国家之前把石油贮量消耗殆尽。
当考虑代替矿物燃料的替代能源时应该指出一点,我们现在的技术是以两种主要的能源形式来依靠矿物燃料——燃烧煤发电,可携带的燃料如油类、汽油、天然气。现在不是所有的国家都依赖煤来发电,例如,1982年,核动力为芬兰、法国和瑞典提供了总的能量需要的40%,英国和美国分别是16多和13%。水力发电较少,但在为全世界的许多地区提供以力。许多科学家确信其它较少引起争端的替代品如太阳能、风力将在下一世纪为下一代提供“清洁”的能源。在多数工业化国家中电力只是该国的总能源的一部分,典型的约是16 ~ 25%。能源消耗的最大部分得自化学的燃料如在汽车发动机中直接转化为机械能,其最大的优点是易于运输、贮存甚至可以在最边远的地区应用。因此,看到最近的科学研究一直注重于发展一种轻便的化学燃料来代替矿物燃料也就不会惊讶了。
另外除了考虑经济和环境的因素,一种理想的替代的合成化学燃料应该从容易接近的原材料中获得而不是从矿物燃料中派生,因此煤的液化不可能考虑作为满意的长期的解决方法。生物衍生的化学燃料也引起科学家和公众的巨大兴趣,从农作物或废料发酵产生的酒精是可以用于燃料发动机的能量丰富的化合物,且必然成为进一步研究的依据。然而,虽然这些生物燃料比矿物燃料较少污染,但它们仍然是以碳为基础的分子,燃烧过程中释放CO2和其它污染物到环境中。很清楚,唯一理想的长期替代石油的代用品是无C的物质,显然氢能满足这种需要。
氢作燃料
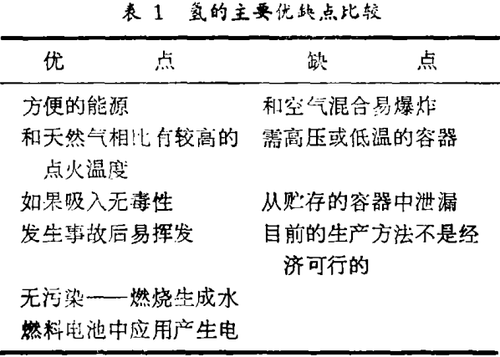
建议用氢作燃料的人和反对者很快分别指出这种燃料的优点和缺点,为方便见,这些观点列举于表1中。
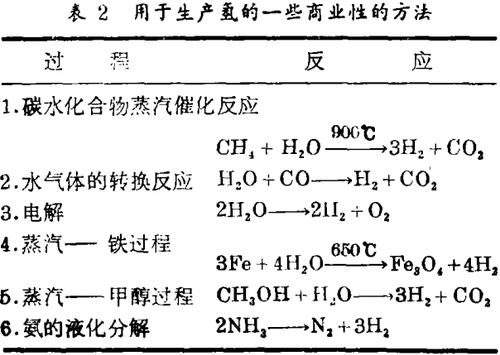
不同于天然气和原油,氢在自然界不呈游离态,因此不能看作是一种初级的能源。它作为一种能量的携带者,犹如电力,必须被制造出来。全世界每年大约有300亿立升的氢用各种化学方法生产出来(表2),氢也具有许多工业上的用途,用来生产肥料、染料、药品和塑料,用于油类和脂肪的氢化、煤转化为汽油和生产甲醇,作为一种直接的能源,氢用于航天项目作动力火箭的燃料以及在称作燃料电池的装置中发生电力。几种大规模的燃料电池已在美国试验,在东京一座4.6兆瓦的燃料电池动力工厂已成功地作业而无污染。
对于氢来说最最重要的潜在性应用也许是作为一种合成燃料在汽车运输中直接地替代石油。作为一种化学燃料,其在燃烧性质方面优于石油,因为其每单位量可能提供更多的可燃能量(每克石油产生48千焦耳,每克氢产生142千焦耳能)。除此外它燃烧生成物是没有污染的水,在氢燃烧过程中也产生一氧化氮但少于碳氢化合物燃烧释放的量。
大多数氢动力汽车的最大局限是它们的驾驶范围有限,典型的为100英哩。这个不足是因为在传统的汽车里只能贮存和携带有限量的氢。
不像石油,它能方便而安全地贮存在汽车的油箱里。而氢要不是在高压的条件下以气态形式贮存于沉重的钢瓶中,就是在低温(-250℃)的条件门液态形式贮存,这两种方法对于广泛应用于汽车都有困难。由于压缩气体易爆炸有潜在危险,由此氢的气态贮存可能不是一种好的方法。相反液态氢作烧料有几点优于压缩的氢气体,液态氢可大量地运输因此贮存更为有效,从含有的能量看,液态氢能钽为气态氢的10倍(液态氢为9920千焦耳/立升,压缩氢1130千焦耳/立升)。
汽车也是设计成用液态燃料的,但是此系统由于低温造成不可避免的问题。例如液态氢是昂贵的,由于氢蒸发或相当大的丢失,并且造成许多工程上的问题,另外液化的过程需要大量的能量——约为氢含能量的60%。现在的研究着重于液态氢的这些局限性,一个特别的研究领域是关于贮存箱的有效绝热来降低氢的蒸发散失。液态氢一般贮存于真空的包上护套的多层隔热箱内,例如改用液化氢作动力的汽车应用具有内层和外层铝壳的贮存箱,25层用玻璃纤维隔开的波纹折皱的铝薄片和25层铝聚脂树脂保证了绝热。这种多层的隔离疏松而具有分子筛的吸附性质。然而事实上的结果也许正如一些专家所建议的:应用液态氢作燃料至少在汽车上技术上是不现实的,这只有时间能作出回答。
解决氢的贮藏问题,至少在汽车上,也许是一种空隙的金属氢化物。氢是一种小的分子,可以被吸附于金属的晶格空隙或空间中,犹如海绵吸收水一样。调节金属氢化物的温度或压力,其吸收的氢能以一种适合于燃烧的速度释放出来燃烧发动机。
已证明有许多金属具有和氢在特定的温度和压力范围内发生可逆的反应能力,有几种已用作金属氢化物的贮藏来提供汽车的动力。一种最有效的系统应用了锑 - 铁合金,其在室温和较低的温度条件下容易地吸收和放出氢,每单位体积贮存氢的量实际上高于以液态贮藏的童,例如锑 - 铁合金每立升可持有96克氢,而液态氢每立升只有70.8克,在氢吸收过程贮存的金属体积增加25%,这一点在实际使用时必须考虑。锑铁合金系统的一个缺点是其额外的重量,因此降低了燃料经济。最近发现了较轻的能吸收氢的金属,其中之一是镁,它在800°C的条件下容易地和氢可逆地结合形成镁氢化物。它不仅轻而且是十分丰富的一种金属,也较便宜。它的主要缺点是要求较高的工作温度。
除这些外,另外有一些含有非常特殊的金属成分更为复杂的合金,对它们吸收氢的性质已有研究,这包含如锆、钒、锑、铬、铁、锰、镁、镍和钙的合金。而Daimler-Benz. 发展了一系列复杂的多金属合金,例如其中一种的成分是Ti0.98 Zr0.02 V0.4-045 Fe0.08-0.11 Cr0.05 Mn1.5,这种合金能贮存其重量的2%的氢,但这些合金在工业规模上制造显然有经济上的问题,以及能否重复生产出符合合金成分要求的问题。
镧也用来作为某种金属氢化物的贮存系统,例如LaNi5,一种可能的忧虑是其氢化物系统自燃的性质,当处理任何一种金属氢化物时这确实是一种潜在的危险。有关的研究已经作出,资料指出LaNi5氢化物的爆炸性和Ti-Fe氢化物系统相同,但危险性比铀的氢化物小100倍。因此有潜在活性的氢化物在贮存期间需要密封的容器以避免分解的可能,尽管如此,LaNi5系统具有一些优点,如能生产非常纯净的氢和以一衡定的压力释放氢,而这些性质对于氢在医药和工业设备中的应用比在汽车中的应用更适合,这系统每小时能释放大约180立升氢。
氢的第二种使用是代替天然气,因为氢的分子比天然气中的主要成分甲烷分子小因此对输送管道要作一些改动来降低氢的泄漏,必须在无气味的氢气中加一些有气味的气体以便能探测到少量的泄漏,也需加些颜料,因为氢的正常燃烧的火焰是不可见的,这些都没有技术上的问题。
最后应叙述一下氢用于核聚变,氢和重氢在约107°C温度条件下化合聚变形成氨,此过程释放巨大的能量,如
这种核聚变是太阳能的来源,也是氢弹的基础,一克氢燃烧释放120千焦耳能量和一克氢经历核变的方式释放109千焦耳能量相比可意识到核聚变的潜在意义。因此,氢可能在将来的能源方面起重要的作用。
从水中提取氢:常规的方法
水是地球表面最丰富的物质,水中含有11多的氢,总计有1.4×1017吨的氢。已提出了许多计划方案来提取这些丰富的氢。所有都涉及到水的分解,因为这是一个吸热的过程,所以需要能量。最近的研究注重于从水中提取氢的方法。
用水电解可获得十分纯净的氢,目前大规模的尖端的商业性电解在全世界范围内进行,具有每天生产250,000磅氢的能力,电和氢的转换效率至少为75%。由于电力昂贵,商业性的电解在电力便宜的地方有巨大的潜力。在70年代中叶,只有有限的商业性水电解在实施,其基本设备将近半个多世纪没有改变:最近的一些研究主要在改进电极隔膜和电解质方面,还有关于工作条件的变化(工作的温度和压力)。
因为镍是一种稀有的金属,能抵御各种浓度和温度的苛性碱腐蚀,因此镍和镀镍的电极广泛应用,它归功于其氧化物薄层的形成,NiO保护了电极。现在的研究也涉及到试验各种新的隔膜,因为传统的石棉隔膜在高温时不耐腐蚀。对于一种理想的隔膜来说有两个基本要求,机械强度和低的电抗。已有几种聚合加厚的隔膜制造出来并在各种条件下试验,例如聚合次苯基 - 石棉,Sb2O5 - 饱和聚合矾,聚合4氟乙烯 - 键的氧化钴表明了有希望的碱稳定和电抗特性,但是目前它们的制造是不经济的。
在电解中温度一般起重要的作用,因为在高温时工作的电压降低导致更为有效的能源转化和氢产生,然而高温增加了电极隔膜和其它部分与碱性电解质相接触那部分的腐蚀,解决此问题的一个方法是用非碱性的电解质。
水也能用热分解来产生氢和氧,但这需要非常高的温度,通常高于2,000°C。虽然实验性的太阳炉产生约3,000°C的高温,且成功地分解水,但这种装置目前是不经济和效率不高的。更为实际的是水的热化学分解。这个过程是使最初的能量,如核聚变或太阳能提供的能,达到1,000°C,然后与电解和热化学循环联合。特别有趣的是“混合的循环”,指其中一些化学反应由热驱动而另一些是和电压低于那些传统的水电解的电解相关。
70年代以来在美国、欧洲、日本的一些研究项目研究了大量的热化学循环,但只有少数表明有在实验室以外进一步发展的潜力。一个广泛研究的循环,硫酸 - 溴混合循环可用下列方程式描述。
这一过程表明这一体系的循环性,因为中间体HBr,SO2和H2SO4均为循环的,唯一需再输入的是水、热和电能。理想的是应该所有化学反应物100%循环,将无废物产生,特别是对有危险的材料(SO2,Br2和H2SO4)格外重要。
水的光解作用
大约在10年前化学家提出一个全新的用太阳能来分解水的方法,即水的光解。大约用285千焦耳能量来分解1分子的水。地球上的太阳辐射波长范围300 ~ 2,060纳米,相当于400 ~ 45千焦耳的能量范围,因此理论上有能力进行上述的反应。然而必须在水中加一些能吸收太阳光子的物质以及传导此能量到周围水溶液的媒质,以促进光解作用。
最早的光化学水分解的报道是含有铈盐光氧化还原反应。即第一步Ce3++H+→Ce4+1/2H2;第2步2Ce4+H2O→2Ce3++2H++1/2O2。铈(Ⅲ)的高氯酸在酸性溶液及254纳米光照射下经过光氧化作用(第一步)产生的铈(1V)离子有热或光化学水氧化的能力(第二步)。然而这一系统因需要高能紫外线辐射以及效率低而看作是不实际的。
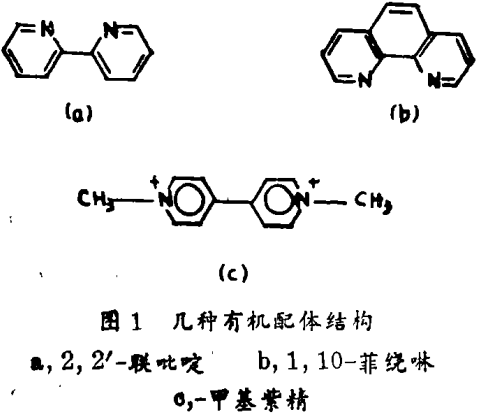
最近,对一些含有有机配体的改变的金属化合物的研究指出它们作为光敏剂 - 化合物的巨大潜力。这些配体如联吡啶,菲绕啉(图1),有机颜料即卟啉。它们能吸收光并能形成高能量的物质,具有巨大的能量来分离水。这种类型中得到最广泛研究的化合物是三(联吡啶)钌(Ⅱ)离子,Ru(bpy)32+。此合成物的性质使其成为一种有吸引力的已激发状态的电子转移反应的候选者。其性质是(1)在其正常四氧化状态下,其在水溶液中一般是稳定的,并不历经配体的光分离作用;(2)在太阳的可见光谱范围内它具有大的光分子吸附能力;(3)随着光的吸收,最低的激发状态在溶液中展示室温发射;(4)最低激发状态的持续时间对于允许在电子转移反应中此激发状态的参与一般是足够的。
当Ru(bpy)32+吸收可见光时一个电子从一个满载的低能量轨道跃升到空的高能量的轨道。在此激发状态(高能量)构型[称为*Ru(bpy)32+]的分子有参与氧化还原作用的能力,因为它可能获得或失去电子,在理论上它也许失去电子给水导致水分解成氢,但实际上,当只有水存在时*Ru(bpy)32+衰减到原来状态重新释放其能量。有几种方法被采用来避免回到这种原来的状态(或称逆反应)。另一种物质如甲基紫精(图1)可加到这一系统中作为一种电子的接受者,即东逆反应发生前消除它的高能量电子。当反应时甲基紫精把电子转移到水中导致水分解成氢。
另一种阻止逆反应的方法是应用称作为胶态分子的微小单位,称作微乳胶。它们能阻止逆反应的电子流动,且仿效光合作用中叶绿体的作用。一些生物液化剂也用于水的光解,例如氢化酶,其催化可逆的氢氧化作用
自从发现了这种酶和叶绿体一起从水中光诱导散发氢后,这种酶获得了实际的意义。
有许多种参与光分解反应导致产生氢的无机和有机化合物。但是除了上面所叙述的问题外,在太阳能直接转化为化学能方面有许多热力学和动力学方面的局限,表现为其转换的效率不会超过12 ~ 13%。虽然看起来这是很低的,但光合作用的效率通常低于5%,目前经过催化剂或半导体电子的水光解反应的效率通常低于1%。不过,应用这两种无限的资源,水和太阳能,来产生无限的能源将继续激发科学家们的想象许多年。
结 语
当我们跨进本世纪末吋,核动力和煤在我们能源经济方面最可能日益起主导的作用,但充其盘也不过是一种暂时的解决,其在矿物燃料纪元的结束和新能源的纪元开始之间提供一座能源的桥梁。这一新的能源纪元可能应用核聚变和太阳能结合作为最初的能源。氢也许然后进入其自己的纪元。一旦它能产生,氢能用管道作长距离的输送,这样替代了煤和天然气,或者氢能制成易携带的燃料代替石油供汽车运输。
[Science Progress,Vol,72 No. 235,1988]