生物化学家有一惊人的发现。人体的化学防御武器抗体可以像酶一样起作用。正像它们被认为的那样,这些抗体酶(abzymes)的研究进展可能使下一世纪的生物技术发生彻底的变革。
哺乳动物的免疫系统经过数亿年的不断进化,达到了现在这种异常有效的程度。抗体在这种防御机制中起着关键性作用,这些复杂的蛋白质分子与单一的抗原发生特异性反应,抗原常常是入侵病毒、细菌或其它异己有机体表面的糖蛋白。
人体和其它哺乳动物可以产生大量不同的抗体——大概有109种。现在,生物技术学家们已发展了把抗体用作酶的方法。酶是加速反应的天然催化剂,但生命有机体只能产生有限数量的酶。被一些研究者称为“抗体酶”的催化抗体是一种新的“人造酶”,它给化学和药物工业带来很大的好处,它们具有酶优于人造催化剂的优点,但却能加速没有天然酶与之对应的反应。人造催化剂常常是诸如铂或钯的重金属,它们虽然可加速许多反应,但却稀有昂贵。酶不仅比人造催化剂有效和专一,而且它们在室温和常压下起作用,因此节约能量,他们也是可更新的资源,抗体酶具备酶的这些特性,和酶一样,生物化学家们能经常不断地用新的蛋白质工程技术改进它们。
还有一点,抗体酶在数量上是少数几千种酶的数倍。酶在相对狭窄的范围内应用,但是抗体酶可以成为大量反应的催化剂#如果这样做,直接的效果是反应更安全,也不存在环境污染,这样生物技术显得更加重要。
酶和抗体都是复杂的链状蛋白质大分子。它们的三维结构取决于氨基酸亚基沿着分子链精细排列的情况。蛋白质工程学家正在研究这些氨基酸序列是怎样决定分子的折叠盘绕程度的,这些分子的形状看上去非常像缠结在一起的羊毛球。他们对“分子识别”过程和活性部位的结构非常感兴趣,对于抗体来说,活性部位是指它与抗原反应的部位;对于酶来说,是指它与底物(与酶作用的特定分子或化合物)反应的部位。
这两种类型分子(酶和抗体)的作用方式是极不相局的。抗体与互补的抗原能保持较长时间的结合,它起指示器的作用,使免疫系统的其它部分能在其上辨认并捕获抗原。另一方面,在释放它所转变的产物和与另外的分子结合前,酶R与底物分子有短暂的结合。酶具有加速所催化反应的任务,使底物迅速转变为产物。
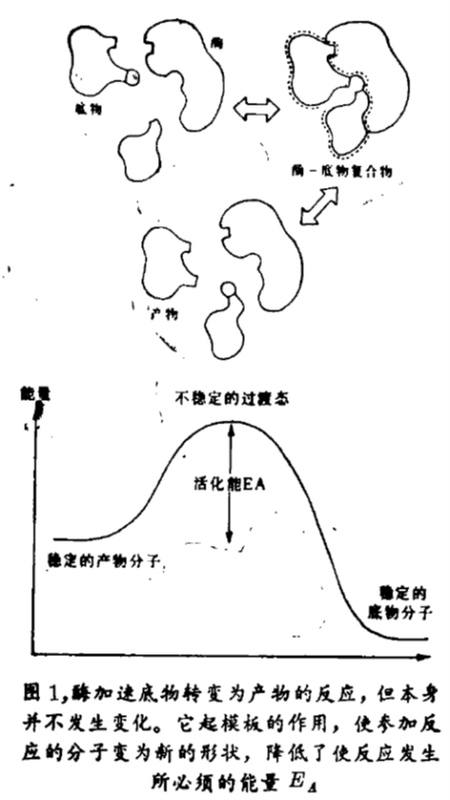
L. 鲍林(L. Pauling)早在1948 年就首先提出了酶催化的理论。他认为,酶通过某种方式与高能、短命的复合物相配对而起催化作用,该复合物处于反应底物和产物的中间状态。在这一假设的构型中,某些键正在形成,另一些键正在断裂,它被称为过渡态。这是我们理解酶和抗体酶是如何起作用的关键。鲍林的理论为实现抗体能像酶一样起催化作用这一创造铺平了道路。
1969年,布兰戴斯大学生物化学家W · 詹克斯(W. Jenks)进一步发展了这一理论。他认为,在结构和电荷排列两方面,酶分子与它催化反应的过渡态呈互补。换言之,酶分子起模板的作用,使底物分子转变成新的形状,即过渡态,随着反应的进行,能量平衡转向有利于能量较低的产物分子一边,因而过渡态不会回复到底物分子。到达过渡态的过程是反应的困难阶段——从能量的角度考虑,过渡态处于底物和产物两边“山谷”间“小山”的顶部(图1)。
到80年代中期,生物化学家们已掌握了很多有关酶是如何起作用的知识。他们中的一些人开始尝试用抗体作为酶。首先,他们得选择适当的反应,预示过渡态的确切结构。接着在实验室合成这一过渡态。如果把这种“模拟的”过渡态注射入小鼠体内,小鼠的免疫系统将产生抗体与之对抗。所提供的模拟过渡态与实际上的十分接近,科学家们应该能用这种抗体来催化反应,这种催化方式与酶相同。那么,这就是抗体酶。
科学家们一直使用产生单克隆抗体的通常技术来产生抗体,这一技术是由剑桥英国医学研究委员会分子生物实验室的C. 米尔斯坦(C. Milstein)和G. 柯勒(G. k?hler)子1975年发明的。它把产生抗体的细胞和迅速繁殖的小鼠细胞熔合在一起,并在实验室内使其发育形成称为杂交瘤的杂交细胞中心。杂交瘤将继续不断地产生抗体。接着科学家们便能试验这些抗体是否具有催化活性。
至少有美国的三个小组和英国的一个小组在用上述方法研究抗体酶。这些小组的领导者是:加利福尼亚拉霍奇(La Jolla),斯克利浦斯(Scripps)临床研究所的R. 勒纳(R. Lerner);宾夕法尼亚大学的S. 本科维克(S. Benkovic);加州大学伯克利分校的P. 舒尔茨(P. Schultz);以及谢菲尔德(Sheffield)大学的M. 布莱克本(M. Blackburn)和D. 伯顿(D. Burton)。事实上,他们都在使用稍比米尔斯坦和柯勒的方法复杂的程序。
这样做是因为:对于单一的抗原,小鼠能产生许多不同的抗体,只有一小部分针对模拟过渡态的抗原产生的抗体才能作为催化剂。但这意味着:研究者们能选择有最大催化活性的抗体,和掌握用蛋白质工程来增加它们催化活性的基本规则。
斯克利浦斯研究所和伯克利的科学家们,几乎同时在1986年底报道了他们首次成功地制得并试验抗体酶的研究,这两个小组都是利用抗体酶催化羧酸酯的水解。由醇和酸形成的酯,是碱和酸形成的普通盐(氯化钠)在有机化学中的等价物,但与盐不同,酯能容易地恢复成它的组成成分、醇和酸。这一水解反应只须添加水便能进行,化学家们能用催化剂加速该反应。
伯克利的小组把现有的抗体和“模拟的”过渡态用于他们研究室的反应。斯克利浦斯研究所的科学家制备了新的抗体。它们都是加速水解反应的抗体酶。斯克利浦斯的小组使反应加速大约1000倍,伯克利的小组加速约1500倍。
这仍比天然酶加速反应所达到的速度慢数千倍。但自从1986年以来,科学家们已设法使最有效抗体酶的活性得到改善,它们能加速某些反应达到很高的速度,仅比天然酶所达到的速度慢约100倍。
由抗体酶催化的首例反应包括像酯中那些弱键的断裂,正如谢菲尔德的布莱克本指出的那样,它们是“催化化学中的儿童滑梯”。目前,各小组已转向研究更有效的抗体酶,它们能使像氮 - 氮三键这样极强的键断裂。某些研究者认为:他们最终能使抗体酶发展成为药物和异常精密的研究工具,用以切断蛋白质的建筑材料氨基酸间肽键的抗体酶。
抗体酶的第三代应用是:药物和化学工业最终能制造它们,但并不是作为它们的最终产物,而是用以催化诸如形成碳 - 氧和碳 - 氮键的反应。这是制造像涂料和塑料等材料的关键步骤。
但这似乎超出了化学家们所能做的。现在,由于抗体酶所催化反应产物的积累,反过来阻碍反应的进行,工业过程还不能大规模地使用抗体酶。生物技术学穿将不得不采取措施来克服这一困难,使产物一旦形成便移去。
同时,在伯克利的P. 舒尔茨小组已通过在反应部位植入新的化学功能团,来增加某些抗体酶的化学容纳力。这样做比让抗体酶催化属于自然界抗体的反应更好。舒尔茨及其同事们在抗体酶的活性部位上,添加那些容易释放或获得电子的重要基因。勒纳的小组在活性部位增加金属原子,因此使某些抗体酶能催化肽键的水解。布莱克本通过精巧地改变“模拟”过渡态的结构,来寻求增强抗体酶活性的方法。
四个小组的其它成员在探索利用蛋白质工程技术来改进抗体酶性能的方法。某些实验室已开始使用称为点致遗传突变的技术。这一技术方法使已知的抗体基因顺序发生改变,例如,用这一方法,蛋白质工程学家能在活性部位植入易弯曲的蛋白质环状侧链,这样抗体酶便能和更多种类的底物反应,因而更实用。虽然在某些反应中,例如在药物方面,具有高度专一性的抗体有其优点,但能与较多种底物反应的抗体酶可能具有另外的用处,比如用以除去污染物质。
并不是每个人对抗体酶的前景都如此乐观:纵然某些抗体酶能使反应加速千万倍,那些特别谨慎的人也觉得抗体酶的加速作用总是比天然酶慢许多倍,那些谨慎的人们还认为,偶然的发现总会超过这些进展。将来科学家们可能会创造合成基因来实现全新酶的蓝图。这种观点假定蛋白质工程不久将会成为精确无误的科学,研究者们能彻底理解有关的规律,按 · 照这些规律,氨基酸在蛋白质分子中的顺序确定蛋白质的折迭方式,因而如果是酶,便决定它如何起催化作用。
另一方面,热心者们相信,掌握设计酶的技术要较长的时间,而不是尽快能实现的。他们还认为:新技术将使快速试验甄别大量抗体的催化活性成为可能。这些新技术将大大加速抗体酶的研究进展,以至它们至少能在按需定做的酶研制成以前,有一较长的繁荣昌盛时期,也许将不会完全退出历史舞台。
在斯克利浦斯研究所度休年假的D · 伯顿认为,抗体酶将继续保持优于人工设计酶的特点,这是因为蛋白质工程学家只能设计相对粗糙的蛋白质链。在酶的反应部位他们所能做的最小改变是用一种氨基酸替代另一种。这包括重新确定约1.5 ?(1 ?=1/10 mμ)长度范围内分子的形状,而抗体酶的反应部位能在约上述1/5的规模内修饰。
许多天然的酶已经某种方式的进化,在选择它们催化的底物时专一性越来越差。这也使得生物体所能代谢的能量和食物有较大的选择范围。另一方面,抗体变得越来越专一,以致它们能认别特定的抗原,避免与“自身”的抗原反应导致自身免疫病,比如某些关节炎。当专一性较小的抗体酶能对大型工业过程和药物目得的用途有价值时,就应设法提高其选择性。
生物技术学家设想,临床医学将列于首先受益于抗体酶之列。例如,被认为是蛋白酶基团的抗体酶,能在反应中非常准确地打断肽键,而在这些反应中,天然酶不能或尚不能选择性地履行这一职责。该蛋白酶的两 · 种可能的应用是:溶解血凝块和除去伤痕组织。研究者们也可把抗体酶发展为抗病毒的制剂,用以进攻酶或病毒膜蛋白中特定的肽键。
布莱克本等化学家们认为,为了实现制备精细化学品时的关键步骤,将来会逐渐增多使用抗体酶作为工业过程的补充。这对于既有“左手性”又有“右手性”分子的化学品是特别有用的,由于相和抗体酶能完全区别这样的两种分子,他们使这种来料加工成为可能。随着基于称为淋巴细胞活素(如干扰素)化学信使的新生物药的面市,控制分子“手性”的能力显得越来越重要,科学家们已研制了供工业使用的天然酶,例如,有关生物转化的工业和学术间的link协作研究计划已在沃里克(Warwick),肯特(kent)、埃克塞特(Exeter)等大学展开。抗体酶将使它们的研究范围更广阔。
直到最近,只能通过小鼠杂交瘤的途径来制取抗体酶的事实限制着它在医药方面使用的可能性。用这种方式产生的抗体酶属于小鼠的组织,因而当使用于人体时,这种外来体易于辨认,并遭到排斥。但剑桥英国医学研究委员会分子生物研究所G. 温特(G. Winter)的研究小组已发展了一种产生“人化”抗体的技术。该技术是围绕小鼠抗体的反应中心嫁接人用抗体材料,这样大部分抗体是人的,而不是小鼠的。大大减小了排斥的可能性。
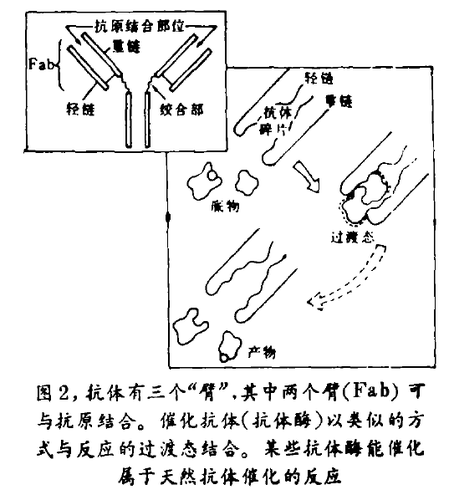
温特,和他在剑桥实验室的同事S. 沃德(S. Ward),开发了一种完全创新的技术,又经斯克利浦斯研究所勒纳的小组和设菲尔德的D. 伯顿和A. 坎格(A. Kang)的进一步完善,用以在体外制取抗体碎片。这些碎片称为Fab(抗原结合碎片)碎片。每一个碎片可构成Y形抗体分子的一个臂。每个臂有两个组成部分,一个重链和一个轻链(图2)。作为催化剂时,抗体酶必须有重链和轻链,二者是有效结合必须的,但完全的抗体分子是不需要的。
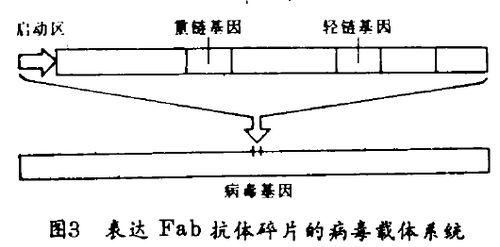
利用这种新技术,科学家们想制取新抗体时,不再需要每次给小鼠注射抗原。而是由动物或人产生抗体的细胞提取基因,首先是轻链,接着是重链 · 这是使用称为多聚酶链反应(PCR)的方法进行的,即用酶来多次复制基因,接着他们把基因集合在约有百万种基因的“图书馆”,并分为重链和轻链,存贮在细菌病毒中(图3)。任意地结合重链和轻链的基因,科学家们便能得到无数的Fab碎片。碎片的基因通过细菌表达出来。也就是说细菌发展成为抗体。
用这种方法,科学家们能通过细菌培养得到数百万种不同的抗体,他们可以像用小鼠杂交瘤那样,迅速、容易地多次试验这些抗体的催化活性。一旦发现抗体具有他们所需要的催化作用,科学家们就能通过细菌培养来产生它们,这要比由哺乳动物的细胞培养快得多,且非常廉价。用这种方法培养人用抗体和啮齿动物的抗体一样方便,因而科学家们再不需要“人化”它们。
按照斯克利浦斯研究小组的观点,试验甄别大量抗体的能力,是指研究者们能筛选出一种可以催化特别复杂反应的抗体——比如,机理尚未完全确定的反应,或很难找出其过渡态类似物的反应。为了催化化学反应,他们可以比较几种不同的方式,或寻找最佳的组合方式。他们认为这一关键问题的解决是头等更要的。
它将使科学家们更迅速、容易、经济地研制出催化抗体。同时,斯克利浦斯临床研究所的A. 希亚特(A. Hiatt),在把有关重链和轻链的基因转移进入两母体植物后,成功地于烟草植物中制成了完整的抗体。看来由这种方式制得的抗体是正常的。
希亚特估计,在四、五年内,像农作物一样栽培抗体,且这样产生它们要比由杂交瘤制备便宜10000倍将是可能的。他认为,植物既是培养催化抗体的理想媒介物,又可用以消除污染物和医药方面的使用。
正像布莱克本和伯顿指出的,我们期望看到,大学的免疫学和有机化学系在研究他们的抗体酶时的相互影响,LINK生物转化计划中的两个主要项目已着手部署,设菲尔德和英国的其它大学与他们的工业合作者一起,将尽快地研究发展有关抗体酶的基础科学。现在,廉价地批量生产抗体的技术已能与经数亿年进化所形成的高度专一性相媲美,生物技术可望成为21世纪占支配地位的技术。
[New Scientist,1990年3月24日]