化学没有周期表如同航行没有罗盘一样不可想象。但是这并没有制止某些化学家正试图改进它。
当法国大文豪巴尔扎克写下名言“没有数字,我们整个文明大厦就会塌坍成碎片”时,也许他已经预计到俄罗斯化学家门捷列夫的洞察力。1869年2月17日门捷列夫在纸上草草记下化学元素符号,根据它们的原子量作了排列,按照当时已知的规律即“具有周期性”的行为,以一组为结束这样方式排列了次序,也许这是化学史上一次最伟大的突破。
门捷列夫的思想全面地改变了化学家观察他们对象的思维方式。现在知道每个化学元素在周期表中有它的序号和固定位置,并且能据此来预测它们的化学行为:即它们如何和其他元素起反应,会生成何种化合物,会具有怎么样的物理性质。
接着,门捷列夫预测了3个元素-镓、钪、锗的性质,那时候这3个元素还没有被发现。因为他确信他的周期率是合理的,所以他在周期表中留下了空位。在以后的20年中,上述3个元素均被发现,它们的性质几乎完全郊门捷列夫所预测的一样。
门捷列夫自己也被他的思想那么快的被证实而惊讶,1889年在伦敦皇家学会一次有声望的法拉第演讲会上,门捷列夫承认他没有估计到能够活着看到“大英化学学会会提到他们的发现,并对周期律的原理和正确性给予证实。”因为作为一条新闻对他的卓越成就广泛传播,门捷列夫当时简直成了一个英雄,而公众对周期表的兴趣也与日俱增。
门捷列夫后来还预测了10个新元素,除了2个以外全部被证实。同时他又提出有几对相邻的元素位置应互换一下,以使它们的性质更加符合周期规律。他认为钴和镍应互换一下,氨和钾也要互换位置,因为门捷列夫认为,位置放错是因为它们的真实原子量与被化学家测得的值有差别。直到1913年即门捷列夫去世6年之后,这类模棱两可的现象才弄清楚。当时化学家们已获得了关于原子的更多的知识。那一年曼彻斯特的物理学家Moseley. H指出周期表中元素的位置不是由原子量而是由它的原子序数决定的。
一个原子的原子序数是由原子核中的质子数确定的,在一个中性的原子中,它等于围绕着核旋转电子数。Moseley还证明了一个特定元素所产生x射线的特征频率,直接和它的原子序数有关。对于门捷列夫来讲,产生混乱的原因是:化学上测得的原子量是该一元素所有的略有差别的若干个不同同位素的平均值(同位素是指有相同的质子、不同的中子的核素)。
不过门捷列夫的直觉还是正确的。原子序数已成功地用在安排惰性气体元素(氦、氖、氩、氪、氡、氙)在被扩大的周期表的位置这一难题上。惰性气体已在18世纪90年代被发现。这些元素一点不活泼,不能和当时已发现的其他元素化合成化合物,所以要探索他们的化学性质还真是一个问题。
其他一些较重的元素也是以类似的方法定位的,它们主要包括从19世纪40年代开始发现的,起始于57号元素镧的15个_系元素,以及本世纪发现的起始于89号元素锕的15个锕系放射性元素。在这两个系列元素中,随原子序数增加,元素的化学性质变化很小,所以把它们放在周期表中的同一位置应该不会有问题。
今天有人甚至把化学上碰到的暂时困难归罪于周期表,除非因需要偶然可以在锕系元素之后增加一些新的人造元素,看来周期表似乎已接近最终形式,但是这并没有阻止普林斯顿大学化学教授艾伦(Allen · L)的工作,他在1992年宣称周期表应扩大到更大的范围。艾伦认为周期表是化学家手中最有用的组织工具,但问题是它并没有提供关于化学键的概念,也没有提供任何关于原子的能量信息,尽管周期表告诉了化学家关于某元素应该有怎么样行为的知识。
金属或不是金属
艾伦提出的新方法涉及主管化学键的原子的最外层电子(或称为价电子),化学家发现对一个原子来讲最适宜的构形是,围绕着核子周围的电子是以不同能量的同心圆或壳层的形式排列的。艾伦用量子力学计算了价态层电子的平均能量,他称之为“构型能(Configuration Energy,简称CE,下同)。构型能大致意味着分离原子需要用多大的能,也可称为固体能带,能带隙较大的材料是绝缘体。艾伦已用他的计算方法分离出在周期表中呈锯齿状的“类金属”范围,以类金属为界可以分成金属或非金属。类金属是碾、硅、锗、砷、锑和碲。
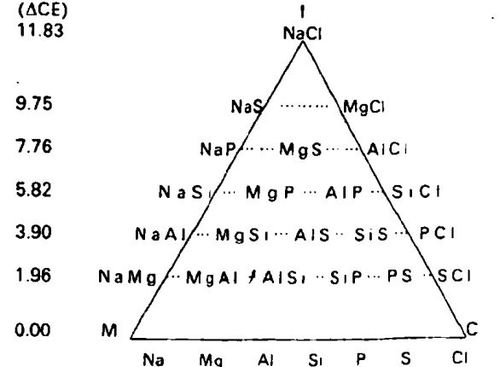
艾伦同时打算预测每个个别原子之间会生成哪种类型的键,以及生成的化合物会有怎么样的性质。在一个三角形中,他依次选择了周期表中的每一排,并以每个原子可能的化合物来排列。三角形每一顶点相应是纯离子化合物,纯共价化合物和纯金属键化合物 · 三角形内部组合代表了由每种键组成的各种化合物,发现靠近每一条边的中间均是化学上或物理上感兴趣的材料,MC边是半导体,IC边是聚合物,MI边是一种少有的电导性材料,即所谓有“津特尔”(Zintl)相的材料。根据每个原子的CE,艾伦计算了每两个可能结合的原子的CE的差别,以及三角形中每一水平排列中平均CE的差别。用这种方法,他得到了一个表示三角形内化合物性质逐渐变化的范围,并据此对某些化合物的行为作了一些有用的预测,例如它们的电性质。
图1经计算的一个元素的键电子的能加上它会生成的化合物(离子、共价或金属)中的键类型的数。这也许能够帮助化学家更精确地预测化合物的行为
但是并非人人认为需要这种基本方法。在莫斯科矿物学博物馆工作的俄罗斯化学家Godovikov. A和他的日本同事Hariya. Y却从另一种角度来看待周期表,他们打算使它更有预测能力和更加精确。他们按照每个原子的电离能被每个带电荷的正离子除后所计算的数值,将所有元素进行分类,他们发现能用这个比值将所有元素分成13个组,每一组的化合物有特定的结*化学和会生成特定类组的化合物,其中某些化合物能和周期表中的竖行相一致。同时他们还鉴别出某些新的组合,像锆、铌、铪、钽,它们都是容易生成络合物的元素,整个争论的结果在于如何扩大元素周期表,现在有些化学家已开始建立不是元素的而是化合物或分子的周期表。实际上这样的想法井不新鲜,早在1862年,英格兰化学家Newland. J躭提出过有机分子周期表,甚至门捷列夫也使用金属氧化物和其他化合物的行为来决定应把,某些特定元素放在周期表的什么位置。
基础材料
分子周期表的主要设计师是Hefferlin. R,他是美国田纳西州大学城,南基督安息日学院的物理学家。Hefferlin研制了两种周期体系,一是“物理体系”,该体系中所有分子含有相同的原子,另一种是含有不同数目原子的分子的“化学体系”。
早在70年代后期,Hefferlin提出了一个双原子分子的完整的周期体系,该体系可分成15个三维框架,框架中的一维是将周期表中组成原子的排数相加,而另外二维则是两个单个原子的行数。
Hefferlin框架中已观察到的具有周期性的特性有:分子中两原子之间的间隔距离,分子吸收各种光的频率,从分子中激发一个电子所需能量,测量了在辛醇和水之间分子本身如何分配。在过去的几年中,Hefferlin研究组已完成了三原子分子的更为庞大的体系,它们和双原子分子的工作相似,为此他们需要25个框架来适应原子之间的不同组合。
现在可以用这些周期体系来推测双原子和三原子化合物的许多特性。中国合肥科技大学的科学家孔凡敖甚至提出了四原子分子体系,该体系要比Hefferlin的简单,主要依据是把所有组成原子的周期数和组相加,可以用这两套数目组成一个网格,例如它的竖行可以展现金属特性如何变化。
化学周期表一般要比这些相对复杂和华丽的形式要简单。今年早些时候,佐治亚大学的King. B为中性的金属锇羟基簇族化合物设计了一个表,这种簇族化合物中的一氧化碳分子本身带有三角形的三个锇原子,金属锇羟基簇族化合物以及与此相似的元素包括钯等的金属羟基簇族化合物非常重要,因为它们在化学工业中用作催化剂。表中的一个主要因素是簇族化合物中金属原子数,而其他则代表了金属-金属键数。这个表列出了9种已知的锇羟基簇族化合物,从OS3(CO)12到Os7(CO)21,并预测了化学家至今还没有合成的新化合物。
和碳相关的化合物
有些化学家还试图设计出有机分子的周期表,依爱华大学的Randic M,一直在研究各种碳氢化合物的异构体,包括是石油成分的辛烷。Randic的18个成员的表是用图解理论推导的数学方法设计出来的,主要依据分子骨架内的联系数。他用这个表预测了诸如表明汽车发动机中汽油燃烧效率的辛烷比和密度。
与此同时,堪萨斯城密苏里大学的Dias. J—直在研究苯环型碳氢化合物,其中的分子包括1个或多个6碳苯环和5碳环。苯环型化合物一直有多种用途,从彩色涂料、荧光剂、有机合成药物的基本原料,一直到塑料的抗静电添加剂等,其中的某些化合物如苯并芘(主要来自化石燃料的产物)就是一种致癌物质,化学家至今只合成了大约500种含苯化合物,只占了预计总数的0.03%,但是Dias已把它们全部归类到一个大的分子周期表中,该表是按照六成员的碳环如何紧密地结合在一起来排列分子的f他已经用它来预测苯环化合物中4个层次的化学反应活性,在过去的一到二年中,Dias已把工作扩展到其他分子家族中,包括像富勒烯一类簇族化合物。
门捷列夫也许会被这些企图扩展和扩大他思想的做法被迷住,但是他们之中至今无人能达到像门捷列夫那样在预测化学元素性质上的先驱作用,门捷列夫的工作一直是化学上一个无可争辩的里程碑。
[New Scientist 1994年2月12日]