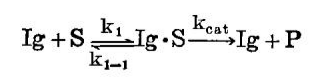[提要]化学家和生物学家们正在为发展对合成及修饰复杂分子有效且具有高度选择性的催化剂而全力以赴。这里记述了两次探索性工作,即催化抗体和杂交酶的生成。这两项工作开发了在设计催化剂中其催化及结合机制的本质。这些体系的特化为窥探分子识别及催化作用的机理提供了新的见解,这又反过来引导设计能应用于化学、生物学及医学的特制的催化剂。
在设计具有高度选择性催化剂方面的最新进展对化学这门学科产生着极其重要的影响,这包括对我们有效合成或修饰某些分子的能力,以及我们为理解在配基结合和催化作用中所涉及的分子的相互作用而做出的种种努力都产生过影响。化学家们正日益精通于合成复杂分子、反式小分子等的选择性催化剂,业已证明手征性过渡金属络合物可作为有机合成中有用的普通催化剂。众所周知的例子有:烯丙醇环氧化作用的酒石酸钛催化剂和手征性铑氢化(作用)催化剂。用亲核基团衍生的含模槽的主体分子和辅因子试图构成催化剂来模拟并实现酶促催化反应。例如,双功能冠醚和环糊精业已发展为选择性水合及转氨小分子底物。尽管这类催化剂在合成中是否有用还尚未得到普遍证实,但它们对研究离析作用、催化作用机理、识别机理,的确具有一定潜力,酶本身就已被用来增加在有机合成作用中的频率。
然而,随着底物的大小及复杂程度的增加,为合理地操纵其结构而生产特制催化剂的能力也受到相当的限制。这些催化剂的合成要求生产具有能区别复合多功能分子的结合位点的双功能分子以及合适的化学基团去完成其后的催化反应。到目前为止,在合理设计能选择结合复合分子的受体方面只取得了有限的进展。大多数努力集中于通过寡聚核苷酸定向诱变的方法修饰现有酶的专一性。例如,枯草杆菌蛋白酶(Subtilisin)和依赖于磷酸吡哆醛的门冬氨酸氨基转移酶(Aspartate aminotransferase)的专一性业已成功地得到更改。天然出现的配基及受体分子也已经过辅因子和氧化还原活性金属的化学修饰,以制造选择性催化剂。例如,业已用EDTA · Fe(Ⅱ)修饰肽和寡聚核苷酸来产生具有选择性的裂解DNA的分子,用吖黄素修饰木瓜蛋白酶(Papain)产生还原性烟酰胺催化剂。
设计催化剂使之具有对某些反应先定的特性如对天然或合成多聚物的选择裂解、缩合或修饰的能力,对药物设计、分子生物学及材料化学将具有极为重要的意义。这些催化剂的合成或特化将会为探索配基受体识别作用以及催化作用的本质提供新的见解。本文的目的在于描述在我们实验室正在开发的发展特制催化剂的两大战略:生产催化抗体和杂交酶。这两种探索性研究的成功仰赖于化学和分子生物学的原理及方法间的结合和相互影响。
催化抗体
设计选择性催化剂的关键在于使之产生具有高度选择性的结合位点。随着单克隆抗体的出现,生产具有同酶类似亲和性和专一性的同源配基结合位点业已成为可能,业已有所选择地生产出了抗生物聚合物如核酸、蛋白质及多糖类的抗体;抗较小的多功能分子如类固醇和前列腺素的抗体;以及抗人工合成多聚物如聚丙烯的抗体。抗体结合配基大小范围在约6-34 ?,缔合常数范围104 ~ 1010 M-1(或高达1012 M-1)。
抗体配基专一性可用下列例子予以说明:抗cis-N苯基马来酸草酰胺的抗体,以低于倍的亲合力同其反式异构体结合;抗3,17 - 雄甾二酮的抗体以低于108倍的亲合力同3α,17 - 二羟雄甾烷结合;抗四L - 丙氨酸的抗体以低30倍的亲合力同甘氨酰 – (L - 丙氨酰)3结合,免疫球蛋白类(Igs)的配基结合位由六个高度可变区组成,大致位于Ig轻链(VL)和重链(VH)多肽链的头110个氨基酸残基.编码VL的基因片段和VH基因的化合接合(Combinatorial joining),不同轻重链的缔合产生至少108种不同抗体分子,扩展受体的其他突变仍在不断发现中,依据这种多样性业已制造出的抗体作为在生物学和医学中能应用于诊断、药物传递、蛋白质和核酸的纯化和特化等方面最为重要的一类受体。因此,对于发展把催化活性引入抗体结合位点的可实施的战略也将能提供具有特定专一性类酶催化剂的一般途径。
对于生产催化抗体而言可以拟想若干战略。抗体的专一性曾经用于选择性地稳定过渡态构型或克服在定向反应模式中所涉及到的能障。催化基因(可以是氨基酸残基或合成催化剂)也可被引入抗体结合位,或者可以用遗传方法选择生产催化抗体。我们这个研究小组最早的努力就是生产催化抗体,主要集中于生产对水解反应过渡态类似物的专一性抗体。
过渡态的稳定化
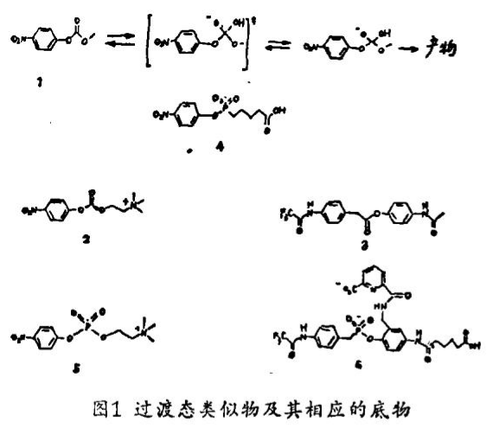
某种抗体产生与某一给定反应的过渡态构型类似的某个半抗原基因会通过稳定与反应物或产物有关的相应过渡态而降低反应的活化能。事实上,许多酶的活性位点就是在结构和电子分布上与限速过渡态互补的,有关酶活性位的研究以及过渡态类似物对酶的抑制作用的研究可以作为这方面有关论点的证据。我们最初研究了对碳酸盐和酯类水解反应的四面体、带电荷的磷酸盐及磷酸盐过渡态类似物的专一性免疫球蛋白。我们选择了这些其反应特征已得到很好表征的反应,目的在于简化催化作用及配基结合的机理研究。我们业已成功地特化了这样的抗体,它们能选择性催化两种水解反应:P-硝基苯基N,N,N - 三甲基铵乙基碳酸盐的水解反应和P-硝基苯基碳酸盐(2)的水解反应。其他研究者们也已生产出第三种催化抗体,即抗甲基吡啶酸含磷酸盐(6)的抗体,水解缺少甲基吡啶部分的类似的芳香酯(3) (见图1)。
在设计第一代催化抗体时要虑及许多因素。碳酸盐和酯类在从底物到产物的反应途径上经历实质性的结构及电子变化,使有可能达到差异结合并稳定过渡态。此外,对这些水解反应的四面体过渡态业已用四面体磷酸盐、α - 二氟酮以及羟甲基基团成功地进行了模拟。水解反应的确并非必需催化活性侧链(如一个亲核的丝氨酸),只不过攻击在底物的极化羰基上水分子易于接近的结合位点。另外还有其他考虑,包括在底物和过渡态以及削弱了对反应产物有亲和力的抗体中常见请别要素的适意性。
因为小分子除非偶联到一个载体分子上才是免疫原性的,亚甲基链拼入磷酸盐过渡态类似物以把半抗原偶联到载体蛋白——牛血清白蛋白和钥孔?血兰素(KLH)上。在半抗原和载体分子之间这一空间臂的长度典型范围在6-8?,这排除与载体侧链的任何立体干涉。把这些半抗原偶联到载体蛋白质的赖氨酸侧链上,然后诱导出抗这些共轭体的单克隆抗体。单克隆抗体的生产尽管比多克隆抗体更费时间,但它具有能提供相对可靠的大量同源Ig的优点(事实上,我们到目前为止在生产多克隆抗体方面还尚未成功)。
曾经发现对四面体过渡态类似物4 ~ 6(图1)具专一性的单克隆抗体选择性地催化相应的底物水解为产物。动力学常数用米氏速率表达式表达:
抗体催化的反应受到其相应过渡态类似物的抑制。过渡态类似物的抑制常数(Ki'S)实际上在任何情况下都比底物的米氏常数(Km's)低,暗示过渡态的稳定化在催化作用中起作用,业已发现半抗原4和5的专一性抗体在氢氧化物离子缩合反应中是一级反应。把受抗体催化的反应速率(vIg= kIg[Ig · S][OH])与依赖于氢氧化物的水解反应之速率(vo H=koH[OH][S])作一比较,给出抗体速率加快了约103 ~ 104倍。这种加速和实验及理论计算得到的归因于水解酶过渡态稳定化的那些加速处于同一范围。
受抗体催化的反应之另一个重要特征在于它们表现出较高的底物专一性。例如,对磷酸盐(4)专一性的抗体并不能催化甲基 – 2 - 硝基苯碳酸盐水解至任何可监测的程度,而对磷酸盐(6)专一性的抗体也不能催化相应的乙酰氨基苯乙酰酯的水解.尽管目前这些抗体催化的反应之速率较低,但它们表明了发展具有为我们感兴趣的底物特制的结合位的催化剂存在一定可能性。
生物物理学研究刚刚开始为了解抗体催化的反应之机理提供一些新见解。化学修饰实验指出酪氨酸和精氨酸在对半抗原(4)和(5)专一性的抗体中起催化作用,而在(6)的专一性抗体中,据认为组氨酸起催化作用。对含有一氧化氮自旋标记的过渡态类似物的核磁共振(NMR)研究表明带电荷的芳香侧链处于半抗原(4)专一性抗体的结合位点。电子自旋共振研究也证明了在这些自旋标记物和该抗体的结合位点之间的高度立体互补关系(τ=15×10-9秒),并提出其结合位点的深度为9-12 ?。
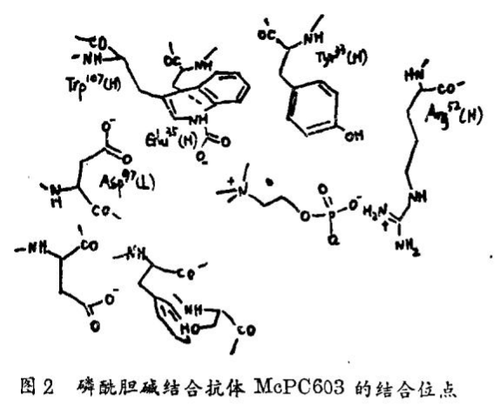
抗体McPC603是与结合磷酰胆碱的抗体T15和MOPC167极其类似的。业已解出了McPC603的三维结构。这就允许对结合位点的残基予以直接指认(图2)。其半抗原被束缚到McPC603的凹穴内,胆碱基团深入内部而磷酸盐则在外部与含水的溶剂接触。重链残基Tyr33(H)和Arg52(H),在到目前为止所有已知其序列的结合磷酰胆碱的Ig中是不变的,经由与磷酰胆碱上的氧原子形成氢键及静电相互作用而结合磷酸盐。对McPC603的NMR研究也提出在磷酰胆碱(磷酸盐)上的几个氧原子和Tyr33(H)和Arg52(H)之间有部分氢键形成。胆碱部分所带的正电荷被轻链上的Asp37(L)残基以及不变区的Glu35(H)中和。而Glu35(H)和Asp37(L)则被深埋于该半抗原结合凹穴。此外,在该半抗原和Trp107α(H)之间尚有van der Waals力。
该晶体结构清楚地表明McPC603的结合位点在立体化学上和电子学上是与磷酰基胆碱的四面体的、带负电荷的磷酸盐部分互补。在有关其氢氧离子催化的(2)的水解作用过渡态的这种对四面体磷酸盐的模拟中,这种磷酰腥碱抗体应该能极化束缚的碳酸盐攻击限速步骤中的氢氧离子。依据(2)的基态结构根本不同于其过渡态构型,Ig对这两种构型的结合亲和力的差异应当在降低反应活化自由能的反应中得到反映。事实上,与4 - 硝基苯基磷酸胆碱类似的过渡态比其相应的底物与MOPC167和T15结合得更为紧密。然而,T15和MOPC167同碳酸盐(2)及其过渡态类似物(5)的差别结合并非完全归因于速率加快之量值,因此,尽管晶体学及结合数据强烈暗示T15和MOPC167选择性地稳定其过渡态构型并由此而降低反应的能障,其他因素也有助于加快反应速率。停 - 流实验并未提供有关硝基苯酚盐离子释放的突发的证据,这种突发消除亲核结合位残基(如Tyr33(H))的进攻,通过和碳酸盐结合产生共价的碳烷氧基——抗体中间物。而且,在T15和MOPC167中不存保留残基,如羧酸盐或可起一般碱作用的组氨酸残基。对Ig T15的重链结合位残基的诱变研究也许有助于确定这些残基在催化作用中的作用,并使选择性诱导组氨酸、门冬氨酸和半胱氨酸残基起一般碱或亲核基团的作用成为可能。
通过对结合位点所必需的组氨酸的化学修饰的研究可以证明对磷酸盐抗体的诱导。这一事实同改变底物的研究结合起来,导致Tramontano等人提出组氨酸起一般碱作用活化结合位——易于接近水。在这一点上还不太清楚的是在这一系统中负责催化作用的过渡态稳定化作用和一般碱催化作用达到什么程度。如果证明一般碱催化作用在该水解反应中的确是重要的,那么对于产生在结合带有一般碱或一般酸的抗体而言就得发展合理的战略。基于另一类过渡态类似物如糖苷酶、蛋白酶、核糖核酸酶及脱氨酶抑制剂来制造催化抗体也是可能的。
接近效应
还有什么样的战略可应用于设计催化抗体?如果我们对酶促催化作用能够拿出新的见解的话,就有可能利用抗体结合的亲和力通过克服反应的能障来提高反应速率。在这种情况下结合能也许可以通过使反应物在抗体结合位上的适当定向而降低反应所需的旋转及平移运动。这种研究可用分子内反应(如大环化合物的内酯化反应)和分子间反应(如酰胺键形成或Diels-Alder反应)。在典型研究中,Bruice和Pandi工业已证明从二羧酸单酯形成分子内酐的速率随着底物中旋转自由度的减少而增加。Bender和Griffiths证明环糊精可以通过对反应基施加定向限制而加速分子内酯基转移反应。Page和Jencks论证了某个分子内过程基态的每一个旋转自由度的冻结增加贡献给(5)的一个当量因素的反应速率。
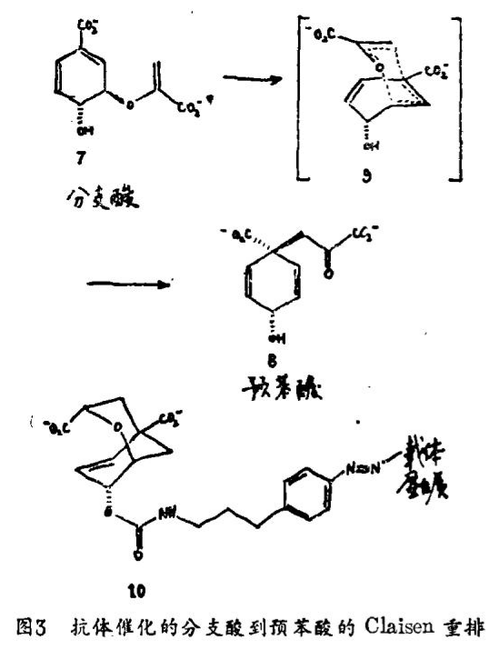
我们就用这些思想来指导抗体的生产,这些抗体能实现分支酸到预苯酸的正规Claisen重排(图3)。这种温热的3,3-σ移位重排是通过一种非对称类椅式过渡态(9)实现的,在这种过渡下碳 - 氧键全部断开而碳 - 碳键的形成还尚未达到任何可估计范围。该反应的活化熵和焓业已确定,分别为-12.85熵单位和20.7千卡/摩尔。在细菌和植物的芳香氨基酸的生物合成中由分支酸变位酶在分支点上催化单分子重排反应大致约为106倍,虽然该酶促反应已被证明是通过一种类椅式过渡态进行的,但分支酸变位酶加速重排的反应机理我们所知甚少。
我们业已表征了分支酸变位酶抑制剂(10)专一性抗体的催化性质。二环二酸(10)达到准确模拟在分支酸重排中所涉及的构象上受限制的活化复合物的程度,对(10)专一性的抗体对反应而言将有较低的熵(或焓)降。依据非催化反应的活化熵,我们可以预期由具有能陷作用的某种抗体可以使速率增加103。
业已鉴定IgG选择性催化分支酸到预苯酸的Claisen重排。该抗体催化反应呈现饱和动力学(kcat=2.7min-1,Km=260 uM;10°C)且受到二环过渡态类似物(10)的抑制(Ki=9 μM)。该抗体加速重排,比热反应多104当置换算因素(kcat/kucat)。这一反应机理和活化参数的表征将提供新的见解:旋转运动也许在这一抗体催化反应中起一种驱动力的作用。
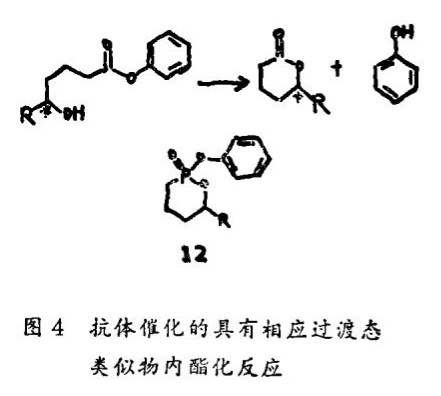
Benkovic及其同事证明由过渡态类似物(12)诱导出的一种抗体可以对相应的底物起催化剂的作用,过渡态类似物(12)是六员环内酯化反应的代表(图4)。该抗体催化反应的反应速率是非催化反应的167倍。而且该抗体催化反应受相应的环磷酸基的抑制。该抗体环化反应是立体专一性的,允许对映体中内酯分离超过94%。这一发现也说明抗体——配基识别作用的高度选择性,并且暗示抗体也许可以用来催化立体专一性化学反应。
虽然上述单分子重排反应和内酯化反应与抗体能够降低反应能障的概念一致,但是有许多工作仍然是旨在确定这些抗体所以能降低反应的活化自由能的机理。另外,了解一下抗体是否可以有效地催化双分子反应(如选择肽键形成或Diels-Alder反应)将是更具莫大兴趣的事。在这类反应中一个重要的考虑就是需要设计适当的半抗原,以避免显著的产物抑制作用。
诱导催化基因
产生催化抗体涉及到的第三种战略是把催化残基的专一性位点引入Ig结合位。人们借助遗传学方法(包括定向诱变和选择),借助选择性化学修饰方法或者通过寻求抗体——半抗原互补关系,也许可以做到这一 点,开发抗体——半抗原互补关系的研究业已成功地用来生产可催化胸腺嘧啶二聚体光解的抗体。
胸腺嘧啶二聚体是DNA经紫外线照射后而产生的。生物体进化了许多体系用来修复胸腺嘧啶二聚体,包括依赖光的诸光反应性酶。尽管对这些酶促反应的机理尚不甚明了,但是业已证明在模式系统中许多敏化剂(包括二氢吲哚、醌类以及deazaflavin)可以光敏化二聚体裂解。因此,人们可以设想某种抗体的结合位(对胸腺嘧啶二聚体是专一性的且包含一适当位置的敏化剂)也许可以起一种选择性光反应活性酶的作用。
业已充分证明许多含有一个带正电荷部分的半抗原诱导抗体结合位中出现一个互补的带负电荷的残基,而用π体系极化的半抗原诱导结合位出现一互补的芳香残基。问题是我们是否可预期抗cis-syn胸腺嘧啶二聚体π体系的抗体可以同包含一个互补色氨酸(对二聚体裂解的一个光敏剂)共轭。我们已经分离并特化了对胸腺嘧啶二聚体具专一性的六种单克隆抗体,其中五种当用大于350 nm的光照射时可以有效地分解胸腺嘧啶二聚体。该抗体催化反应具有双相动力学特征,产物释放表现化学计量突发。其慢相动力学和米氏速率表达式一致。机理研究提也在裂解反应中有一个色氨酸残基参与(抗体并非对胸腺嘧啶二聚体专一性,但含有色氨酸结合位,所以并不能催化二聚体裂解)。
化学修饰也许可以用来把合成催化基因(如氧化还原金属)、亲核基因及辅因子引入抗体结合位。用化合催化剂衍生而来的相对小的亲水及疏水凹穴也可以通过专一性底物结合生产加速水解反应和转酰胺反应的模拟酶。最近,Kaiser及其同事业已用黄素类似物修饰了蛋白水解酶(木瓜蛋白酶)的结合位以生产黄素木瓜蛋白酶,Sluka及其同事和Chen分别用EDTA. Fe(Ⅱ)和菲咯啉-Cu(Ⅱ)修饰了较小的DNA结合蛋白,以生产裂解DNA的分子。如果把周样的战略用于抗体结合位,也能提供具有特制专一性的半合成催化抗体。
这种探索性研究的关键在于发展新的温和方法去选择性修饰具有随后可以衍生的特殊反应性的残基(如硫醇类)较大、较复杂的蛋白质、我们最近发展了一种用普通化学法把硫醇选择性地置入免疫球蛋白的结合位的方法,这是基于应用可裂解亲和标记试剂完成的 · 这个硫醇是否可以被选择性地衍生出某个合成催化基因还有待研究。二者择一地,定向诱变也许可以用来选择性地把硫醇引入某个抗体结合位。发展出在大、肠杆菌(E. coli)表达抗体结合区域的有效体系将硬这一研究成为更具吸引力的探索性研究,在这两种情况下,可以证明把抗体结合专一性和有效合成催化剂结合起来将是设计催化抗体研究中最有效的探索。
杂交酶
我们业已描述了许多旨在探索天然受体的专一性以及生产具有特制专一性的精巧催化剂的工作。在设计新型催化剂的过程中开发天然催化机构也是可能的。业已做出的一种很大众化的探索是借助寡核苷酸定向诱变的方法来重新设计现有酶的活性位点。二者择一地,也许可以附加或取代整个结合及催化结构域来生产具有奇特专一性的杂交酶。例如,把肽专一性的结合结构域选择性融合到有效水解酰胺键的某个催化结构域上,也许能产生序列专一性的肽酶;把对核酸专一性的结合结构域选择性融合到某非专一性磷酸二酯酶上也许能产生序列专一性的裂解DNA或RNA的酶。最近有报告报道了有关人和酵母菌磷酸甘油激酶的两个功能性结构域可以在不损害催化活性的条件下发生主体交叉的情况、使人们倍受鼓舞。
我们把这一战略应用于设计能在特定长度及特定序列的识别位点上裂解单链RNA,单链DNA或双螺旋DNA的序列专一性核酸酶,而设计这类催化剂的一个关键要求即磷酸二酯键的水解反应所涉及的裂解机理,这样就可以用酶法来控制由此而形成的片段的末端。到目前为止还没有能有效地水解DNA磷酸二酯键的任何化学催化剂。加之,也没有等价于在特定位点选择性水解单链RNA及DNA或水解较大双链DNA(>10万个碱基)的限制性内切酶。这样的催化剂对于研究核酸的结构与功能以及在制图谱及测序方面极为有用。
葡萄球菌核酸酶(Staphylococcal nuclease)在A-U或A-T丰富区水解单链RNA,单链DNA及双螺旋DNA的磷酸二酯键,其水解速度超过氢氧离子水解速度大约1015倍。单链ONA或结合了DNA的蛋白质与某一寡聚核苷酸结合结构域的选择性融合,将会产生一种特定序列的杂交酶。而且我们面临着选择性修饰并偶联带有复杂功能团的较大生物聚合物的问题。必须把该寡聚核苷酸结合位与葡萄球菌核酸酶融合以便使该复合底物从功能上与催化残基匹配。该偶联反应也必须能高度选择性地并能在温和反应条件下进行。就这类研究而言,葡萄球菌核酸酶是一个很理想的候选者,它是一种其特征已得到很好表征的、由一条含149个氨基酸的多肽链组成的稳定的酶分子。其酶促活性需要Ca2+,这为调节该酶的作用提供了手段。葡萄球菌核酸酶的结构及机理业已从一系列化学、物理及遗传学研究中得到阐明。对葡萄球菌核酸酶——二磷酸胸腺嘧啶(pTp)-Ca2+复合物的X射线晶体结构业已决定到1.5? (分辨率)水平。抑制剂pTp的嘧啶环嵌进酶分子表面的疏水口袋内,并且其5' - 磷酸和Arg35,Arg87邻近;Glu43被认为是活化进攻性水分子的一般碱,而Arg35,Arg87和Ca2+则是用来稳定该三方晶二嘧啶过渡态的构型。
我们最初选择一种特定序列的寡核苷酸作为结合结构域,因为寡核苷酸在沃生 - 克里克碱基配对基础上和单链DNA或RNA以很高专一性和亲和力相结合。而且,可以用固相化学法很快产生寡核苷酸,从而提供了许多可能的专一性。该寡核苷酸通过一对二硫键偶联到酶分子上有两个原因:二硫键交换反应(ⅰ)可以在温和条件下以高产率进行;(ⅱ)也可以由于在DNA或葡萄球菌核酸酶中缺少竞争性游离巯基时以高度选择性完成,这一战略要求在该寡核苷酸的3'末端以及在该酶的114和116位残基上引入游离巯基。
该杂交酶的专一性是通过用32P末端标记单链DNA或RNA(限定其长度或序列)来测验的。杂交酶位点专一性地裂解靠近寡核苷酸结合位的靶核酸。相反,未衍生的突变酶在富含A-T,A-U位点相对非专一性地进行裂解。
这些杂交酶能位点专一性地裂解含有显著二级或三级结构的较大的天然RNA或DNA吗?为了回答这个问题,有人用某一含22个核苷酸的结合位同M1 RNA(大肠杆菌核糖核酸酶P的亚基)中的发夹环杂交产生了一种杂交酶。这一杂交分子的确在预先限定的磷酸二酯键上裂解底物。而且,裂解反应可在室温下进行。
展望
本文描述了设计选择性催化剂所应用的两个战略:设计催化抗体和杂交酶。这些战略业已成功地用于生产酰基和磷酰基转移反应以及碳 - 碳键形成和断裂反应的催化剂、这些体系的特化已为了解识别及催化作用的分子机制提供了新的见解。现在我们面临的挑战在于把这种思想扩展到设计对化学、生物学、医学等具有普遍兴趣的其他一些反应的催化剂。这一目标的实现将取决于增加化学和生物学之间的相互作用及相互影响。
[Science,1988年第240期]