歉收年
我在1955年完成胰岛素顺序研究工作后,几乎有几年没有取得什么大的成就。我想,在许多人的研究生涯中都会出现类似的情况,它使人沮丧,有时甚至会使理想破灭。我发现,这时最好的矫正方法就是始终向前看。当一个实验完全失败时,最好不要花太多时间去烦恼,而应该继续设计并开始筹备下一个实验。这样,你总是充满信心,富有朝气,不久就会忘记烦恼了。但这种态度有个缺点,就是使写这类文章变得很困难,因为若你总是想着将来,就会忘掉过去发生的事情。
胰岛素工作接近尾声时,人们常问我下一步准备做什么。我的回答通常是:知道结构仅是开始,下一步要发现它的含又及功能。我总是不善于预测未来,特别是我自己的研究计划,虽然我曾尝试着做些计划中的工作,但我的兴趣却开始转向其它方面,这可能是因为顺序分析的癖好已经抓住了我的心。
在这歉收年,有几件事值得一提,虽没有可发表的结果,但它们对以后我在核酸方面的研究工作有很大影响。第一件事是1954年,克里斯 · 安芬森(C. Anfinsen)在他的假期里访问了我们实验室。克里斯一直非常热心于使用放射性同位素标记的技术,我在与他的讨论中感到了这一点。起初我认为用同位素是物理学家们的事,仪器和技术都超出了我的研究范围。但我不久就发现事实并非如此,而且当时我们已经可以得到几种有放射活性的底物了。我们紧密合作,用35S注入大鼠,期望制备出有放射活性的胰岛素。可是这个实验失败了。然而,从此以后我就完全转到放射性同位素及放射自显影技术的研究方面了。这种技术是简单的,非常有效的工具,在把它与纸方法(纸层析及纸电泳)联合使用时,尤其如此。从离子交换层析应用于分离链后,纸方法失去了吸引力,逐渐被层析柱和部分收集器取代了,因为后者更准确且能重复。我却从没真正转向使用层析柱的方法,还保留有对纸方法的某种感情。因为用双向纸层析技术分离物质,看到从一个点中扩散出很多点,对我充满了吸引力。这较之从层析柱中收集无数的分离成分,再分析它们,并以预料到的清晰无误的数据来结束实验要好得多。在纸上没有明确的数据,就会有更多的机会遇到意料之外的发现,虽然我对纸方法的偏爱带有感情色彩,但我想它后来应用于RNA的研究的成功,使它有了科学的依据。
用32P标记比35S标记更好,一些蛋白质,如著名的卵清蛋白,可用32P标记,又如胰蛋白酶和糜蛋白酶,可用二异丙基六氟磷酸32P,在它们的活性中心标上32P。用这种方法虽然只标上了蛋白质分子中的一或两个氨基酸残基,但经部分水解,并在双向纸层析或纸电泳分开后,再经放射自显影就可得到较简单的图片。我对推测肽顺序方法的进展特别感兴趣,而并不想谋求设计出全部氨基酸分析的标准过程,因为后者有点浪费时间和令人乏味。32P标记的蛋白质特别适宜于新方法的开拓。例如,可从32P标记的蛋白质,经酸的部分水解后得到的放射自显影图中,得到有用的信息,用这种方法显示出弹性蛋白酶中标记上的丝氨酸周围的顺序,同胰蛋白酶和糜蛋白酶是一样的。每个标记上的残基电泳时都有一个特异的指纹带,我们依此设计出一种技术,即通过放射自显影而不是通过氨基酸分析来测定氨基酸顺序。这种方法的主要原理是,带放射活性的肽链中通常混杂有大量非放射活性的成分,但它们都是放射性化学纯的,因此放射自显影可反映出简单的,而且是更易于破译的指纹图谱。指纹图谱中不同的带之间的关系,可将它们进一步部分水解后确定。从肽链带的电泳行为可获得极性氨基酸的信息,从层析中可获得中性氨基酸的信息,用异硫氰酸苯酯处理或用高碘酸处理可得到自由氨基的信息。用这些方法常可测定特异标记上的氨基酸残基周围4 ~ 5个氨基酸的顺序。那时与塞扎 · 米尔斯坦(C. Milstein)的谈话对我特别有益,他在地下室走廊的另一头致力于磷酸葡萄糖变位酶的工作。我们在一起用32P标记了它的活性中心,并测定了活性中心周围五个氨基酸的顺序。虽然这是我们唯一的一次合作,但我后来与他保持的持续联系给了我很大的帮助。
我用放射自显影的方法测定蛋白质全部顺序的想法怀有雄心,但在实践中不很成功。这个想法就是准备20个蛋白质样品,每个样品标记的氨基酸不同。我选中了在分离的输卵管中,较易标记上的卵清蛋白。用蛋白酶消化蛋白质样品,对经过消化的片段用电泳和放射自显影的方法分离开。假设分离出的肽是纯的,那么它的氨基酸组分可从电泳区带中它们的放射活性(X射线胶片上呈黑色)来推测出,然后用埃德曼测序步骤处理纸,洗脱掉苯乙内酰硫脲,留作下一次放射自显影备用。每个肽链氨基末端残基就可由第二次放射自显影中无带或弱带而被测定。通过在纸上进一步作埃德曼(Edman)降解,就可逐步测定每个肽的顺序。想法很大胆,但在实际工作中行不通。当然,若它能成功的话,当然很令人兴奋,并能改变部分水解方法的地位,就可以较快速且较简单地操作了。我们在这上面花费了大量时间,但仍存在一个问题就是这种方法是否真正可靠。我在当时很幸运地得到了在英国医学研究院研究的终身职位,没有通常必须发表文章的压力,使我能致力于从事长期的试验性工作,事实上、只有少数几个人能选择这条路走下去,我感到有责任继续深入探索。这种工作也合我的个性。我喜欢做别人没有想到的事,而不是和别人竞争谁先完成预定的计划,我偏爱把精力集中在实验研究上,而不是得出最终结果,虽然这个工作后来失败了,但这个实验设计和我们以后发明的DNA测序方法很相似,所以也是我们研究蛋白质测序时失败的补偿。这段经过表明了我们顺序分析思想的发展进程。我只后悔它的失败对我杰出的协作者比迪(Biddy) · 西格尔是多么不公平,他花了大量时间并熟练掌握了整个操作步骤,但他的名字却从没见诸文字。
在胰岛素工作中,我是由拜特(Beit)研究员基金资助的,整个资助过程长达7年,我非常感激这持续的资助,它使我能将所有时间都花在生化研究上。此后我就由英国医学研究院资助了,开始是作为院外科学家形式资助的。1962年,我到英国医学研究院一个新建的分子生物学实验室工作,在那里我参加了由马克斯 · 佩鲁茨(Max Perutz)领导的实验小组,他从卡文迪许物理实验室来,实验室中的人员包括有克里克(Crick),布伦纳(Brenner)和史密斯(Smith)。新的实验室分为三个多少有点各自独立的部门,马克斯 · 佩鲁茨是主席。蛋白质化学部后来成为蛋白质和核酸化学部由我领导。在这里有我以前从没有过的许多空间,这意味着我可以大大地扩充地盘,我想继续做实验工作,不想指挥很多人,新实验室给了我一个机会,能把在蛋白质化学中有相同兴趣的人组织在一起,组成一个有活力的小组,其中几个人由我直接领导,而另外一些人则由资历较深人员指导或独立工作。他们是尤恩 · 哈里斯(Lenan Harris)及布赖恩 · 哈特利(Bri-an Hartley),他们与我在生化系有密切的联系,面且每个人都有自己领导的小组。后来米尔斯坦也入盟了,这个实验室迅速获得了声誉,使我们可吸引大量的博士生及博士后研究人员,他们的加入保持了实验室的活力及势头。开始时我们有足够的房间使每个人都可占据一块地方,看起来很奢侈,但这维持不了多久,不久实验室就挤得不能再挤了。事实上,在很拥挤的情况下,工作似乎开展得更好了。
我觉得转到新实验室,对我转向核酸顺序研究有一定影响,起初,我对核酸研究没有多少兴趣,我常参加戈登本会,在那里的讨论主题包括蛋白质和核酸,我常坐在那里等待核酸问题讨论结束,回到蛋白质研究方面来。当然,与克里克等人在一起,很难忽视核酸顺序研究的重要性,最初的影响来自于约翰 · 史密斯(John Smith),他是新实验室中的核酸问题研究专家,对我帮助甚大,所以我可以在这个新领域向他求教。他可能会觉得我硬挤进了他的研究领域,但他并不如此,还总是热情地向我介绍他长期从事核酸研究的经验 ·
RNA的研究
核酸测序起初似乎较蛋白质测序难得多。直到60年代初期才取得了微小的进步,部分原因是缺少纯的较小的核酸底物,部分原因是核酸的成分,因为核酸只有四种单体,所以当时预料它的结果分析比蛋白质的20种氨基酸难得多,必须能分离开较大片段的降解产物,而且它们之间须有一定的重叠部分用以推测整个分子的顺序 · 另一方面,核酸只有四种组分,使最后阶段的分析简易得多,分析核酸衍生物是一开始研究时遇到的主要困难,由于技术的改进,而且研究较大分子的分析问题日益重要,才使目前的核酸测序较蛋白质简捷了许多,这是因为蛋白质的分析有许多时间花费在鉴定氨基酸衍生物上,而现在DNA的测序方法可以完全去除最后的分析步骤。
第一个被测序的核酸实际上是第一个提纯的小RNA,即丙氨酸tRNA,霍利(Holley)和他的同事们提纯了它,他们用的测序方法很类似于蛋白质的测序方法:酶的部分水解后用离子交换柱分离产物。他们用的酶是核糖核酸酶T1,因为它只特异切断链中腺嘌呤的3'端键,这种方法是其后大多数工作的主要降解方法。
我们测定RNA的顺序,用的是快速及简单的分离方法,这是受我们以前用32P标记蛋白质经验的影响。每个核苷酸都含有三价磷原子,RNA又特别适合于在体内进行32P标记,再配上非常灵敏的放射自显影检测,这种方法就有可能成功。用柱层析分离产物好像太复杂了,简单并解决问题的方法是用双向纸电泳或纸层析,这种方法分离复杂的从大片段中部分降解下的小片段产物非常有效。总的来说,用简单的纸方法不能很好地分开寡核苷酸,但我们可以发明一种双向方法,即先醋酸纤维膜电泳,再离子交换纸电泳,这种方法较以前分离效果好。
曾有人问我:“在你的科研生涯中,最激动人心的时刻是什么?”“有新发现时,你有何感受?”这样的问题通常来源于人们的普遍看法,他们认为,科学进步依赖于意外的突破或灵感的出现(如阿基米德跳出浴缸,或沃森和克里克发现DNA双螺旋)。对我来说,并不如此。我很难回忆起有过任何突然的振奋,虽然曾经历过那样的时刻,但更多的是与小的逐渐的进步联系在一起的,这许多小进展比那突然的大步跃进所获得的乐趣,机会更多。当然,我清楚地记得,巴特 · 巴雷尔(B. Barrell)每天一早的工作常是冲洗放射自显影胶片,有一次他跑到实验室来,手里挥舞着一张漂亮的、斑点分明的胶片。在我们以前积累的一大堆徒劳无功、杂乱的胶片面前,这肯定是件令人振奋的事情。
图1是用核糖核酸酶T,降解r RNA后的放射自显影图谱。在这种降解中,所有产物的3'端都是腺嘌呤,图中有三个二核苷酸,九个三核苷酸,它们大多数都占有单一的位置,这样,就可简单地通过它们的位置来确定10个核酸的顺序,从而避免了大量的后期分析工作。这是我们雄心勃勃地打算在核酸测序过程中消除化学分析步骤的第一个胜利。大片段核酸的成分可用方格图确定(图1右图)。所有片段均含有一个腺嘌呤。对迁移率影响最大的就是尿嘧啶,它的存在与否把图中的点分成两组,所有不含尿嘧啶的寡核苷酸是跑得最快的一组,含一个尿嘧啶的跑得较慢,依此类推。这些组可画出曲线图或方格图,图中的轴给出了胞嘧啶和腺嘌呤的数目。随着这一进展,我们发明了几种鉴定已分离的核苷酸的方法。这是32P标记肽链工作的延续。其中一种方法是用5'核酸外切酶部分水解从胰或T1核糖核酸酶降解的寡核苷酸。再在DEAE纤维素上,于pH1.9的条件下走电泳。降解产物都有相同的3'末端及不同的5'末端,走电泳时,它们会依大小顺序排列开。通过比较两条相邻带的位置,就可确定它们的不同性质了。
另一种实用的方法,采用的是“流动斑点”技术,也称为“方格图步移法”。是以上双向方法发展的产物,主要用于DNA的分析。它首先由维克托 · 林(Victor Ling)用于测定长的腺嘌呤产物的顺序。核酸外切酶消化的片段在双向系统中依其分子大小分开排列的方法设计,使得每个点与邻近的点的不同仅差一个枝苷酸,但用这种方法确定腺嘌呤及乌嘌呤还没有绝对的把握。
含120个核苷酸的5SrRNA见我们测定新RNA顺序的合适底物,布朗利(Brownlee)完成了它的全部测序任务。那时,它是被测序的最大的RNA。我们当时还测定了已知其部分头蛋白氨基酸顺序的噬菌体R17的相应核酸顺序,测序的主要目的是尝试破译遗传密码。当然,破译工作已由在测序之前就已经大大发展起来的完全不同的体外翻译技术解决了。不过,R17的测序结果是一个有用的对它正确性的确认。
在核酸研究工作中,我较以前有了更多的合作者,我非常有幸曾与他们一起工作。其中许多人是来自美国的博士后研究人员。我们常收到许多申请,使我们在这些杰出人物中作出选择变得很困难。主要的问题是我要找的人不应仅仅有辉煌的专业背景。因为找一个合适的合作者的最重要条件之一,就是你喜欢他并能友好相处,但这从参考文献中是看不出来的。当我考虑约翰 · 多尔松(Donelson)时,其中一个审查人加上了这样一个注解“我想你会很欣赏他的幽默感”。我发现这个评语对我选择他非常有益。成功的合作必须有相互间完全的理解和信任,分享新思想与智慧。若发生人际间的摩擦只能会使工作受损。我们研究小组的气氛总的是好的,但有一次,当我们开始研究DNA时,组中成员为数过多,同时出现了某种程度的争论不休和令人不快的感觉。这使我很烦恼,不知所措,因为以前从没遇到过这样的问题,我采取了忽视的策略。我认为这是最好的策略、设想他们都是朋友并且都会出于惭愧而认识到自己行为的愚蠢。
在做核酸工作期间,幸亏有我的两个助手,巴雷尔及库尔森(A. Coulson)的帮助。当我从蛋白质研究转向RNA研究时,我准备找一个助手,但很少人申请。巴雷尔是唯一可能的人选,他是刚从学校出来的年轻人。虽然没有我们需要的合格的专业水平,但有很高热情。我与他谈了一次,决定冒险启用他。他有令人惊异的大量分子生物学知识,可能是他以牺牲正规学校学习为代价而自学得来的。他是格洛斯特州人,带有浓重的地方口音,是我的同乡。不久他就成为第一流的测序专家,后来成了一个组的头。他逐渐接管了越来越多的核酸测序工作,而我的主要精力还是在方法学上,这意味着我必须再找一个新的助手,我幸运地发现了库尔森,他在以后的DNA工作中是我的主要合作者,他以他沉静的性格做每一项工作。迄今为止,有内向性格的我仍愿意与开朗并有外向性格的人共事。我很羡慕他们,并发现和他们在一起很受鼓舞。库尔森则不同,我俩的个性都很沉静。当我开始变得成熟后,才感到外界的影响对我不起多少作用了,但在实验室中却总是挤满了喧闹的人群。
DNA的研究
60年代中期,我们小组的肯尼思 · 默里(Kenneth Murray)首先开始了DNA方面的工作,他改进了双向系统,可分离并分析短的脱氧核糖核酸链了。但那时还没有办法将测得的短顺序在DNA链上定位。DNA分子太大,纯化出的最小DNA是单链噬菌体基因组(如ΦX174),大约有5000个核苷酸,超出了我们所用方法检测的范围。另一个困难是缺乏合适的降解酶系统。RNA测序主要依靠核糖核酸酶T1及它对鸟嘌呤的特异性。但这种情况不适于DNA。对后来DNA测序起着决定作用的限制性内切酶在当时还没发现。1973年,我们用与RNA测序相似的方法已能测出约50个脱氧核酸数目的DNA。但这种方法既繁复又缓慢,真正测定遗传物质的大分子顺序还需要一个完全新的方法。就像部分水解的作用一样,有些工作为使用复制方法的顺序技术的发展,提供了条件,特别是韦斯曼(Weissmann)和他的同事们的工作。RNA噬菌体QB合有RNA多聚酶,可复制自身RXA,他们就发明了一种漂亮的脉冲标记术,以推导出RNA的顺序。显然,DNA多聚酶可使DNA复制,1969年,吴(Wu)等人用它测定噬菌体人的粘性末端顺序。这段含十二个脱氧核苷酸顺序的测定,实际上是DNA第一次测序。
1963年,伯格等人发明了一种对DNA特异酶切,且与复制过程联合使用的漂亮方法。在正常情况下,DNA多聚酶的底物是三磷酸核糖核酸。所以,用一种三磷酸核糖核酸(如rCTP)及其它三种dNTP培养,在DNA链复制时,所有de就会被rc取代,形成的链在碱性环境或核糖核酸酶存在时不稳定,从而实现了对C特异的消化,其它脱氧核苷酸的分析也可照此办理。看起来这种方法很有希望,我们在这上面做了大量工作,DNA多聚酶工作时,需要单链DNA作为模板,还需一段与模板特异区互补的引物。我们用噬菌体f1作为模板,并打算用噬菌体已知的壳蛋白氨基酸顺序推导出引物的顺序。主要的问题是怎样作成这段引物。喀拉那(Khorana)和他的同事们在当时已能人工合成小片段DNA,但周期太长而且专业性又很强,我们没有经验。幸运的是那时我参加了一个会,遇到了弗赖堡大学的汉斯 · 考塞尔(K?ssel),他在喀拉那实验室工作。我发现他有同样的想法,正想合成这段引物,所以我们决定合作。经过一年多的艰苦劳动,他和费希尔(Fischer)合成了八个核苷酸的引物。若我们能再等一年,就可从限制性内切酶酶切片段中得到所需引物了。这种用RNA替代DNA的方法很好,我们用它测定了约80个核苷酸。计划合成另一段对应于已测序的3'端引物,进一步测序得到另外80个DNA顺序,以此就可以逐渐测得整个基因组的顺序。但这个过程显然太慢了,因为许多片段需要分析,而且还有大量引物需要合成,幸运的是研究方向有了改变。
在上述实验中、我们想得到高标记的DNA,因此用的放射活性底物在低浓度下就有很高的特异活性。用32P-ATP时,常发现DNA产物的合成在A结合之前就终止了,我们设想这是因为酶在作用过程中把ATP用完了。这表明DNA顺序研究又有了一个新发现。若我们能制备有相同5'末端的混合物(与5'末端的引物相对应),并在A处终止反应,则这些链的不同长度就表明了A在链中的不同位置,这种方法也可应用于其他三种DNA,由此可推导出整个DNA链的顺序,我们试验了不同的根据分子大小分离片段的方法,其中聚丙烯酰胺凝胶电泳最令人满意,它比我们能想象到的所有方法都更有效。电泳时它可保持合适的DNA变性状态,300 bpDNA长度以下的所有片段都可依其各自大小不同分离开,小片段较大片段泳动得快,相邻片段虽然只差一个碱基仍可清晰地分离开。
这种新的DNA测序方法,是我曾有过的最好想法,非常自然与成功,所以我才这样详细地描写它,但必须承认,我不能肯定它真是这样产生的,我确实不记得怎样有了这个想法,却记得在做了一些初步的实验后,与艾伦 · 库尔森和约翰 · 唐尔森(Donelson)讨论了实验结果。我觉得上述的解释在某种程度上,可能来源于我想在讲座时试着简明地阐述,以后常常重复,使它成了我的“官方语言”,而不完全是实际的记忆。
首先想到的是用低浓度的底物,尽管效果不好,我们仍不愿放弃这个很有希望的想法,后来在反应条件上做了一些完善,形成两种相似的技术(我们称之为加减法)。它比以前的测序法都快捷,我们用这种方法测定了大部分和ΦX174的顺序。不久就有了更有效、更可靠的方法取代了加减法,它需要制备有不同的末端产物(都有相同的3'末端DNA),且各产物量均等的混合物。加减法就不是这种情况,产物片段的长度范围很小,一次实验只能得到较短的顺序。取得相同效果的另一种方法是科恩伯格(Kornberg)和他的同事们发明的,用相似于正常DNA多聚酶底物的ddTTP作为链的终止,因为ddTTP无3'羟基,所以不能使链再延长。但它作为DNA多聚酶底物较正常TTP的效果不好,若有合适的四种dNTP及ddTTP的搭配浓度,我们可以设想反应后的不同长度的DNA链都在其3'末端有ddt。起初主要的问题是ddTTP供应不足,在德国召开的一次会议上,我见到了盖德(Geider)他制备了一些ddTTP,并很友好地送给我一些,我们用它进行了第一次实验,就从放射自显影中,得到了很长顺序的,有相同放射强度的,漂亮的清晰带。显然,这比加减法好得多,这以后遇到的问题,是如何得到另外三种以前从没合成过的ddNTP。一个药物公司的代表告诉我,他的公司打算制备一些,含使我们等了大约一年,再见到他时,他漫不经心地告诉我,他的公司还没制备。所以艾伦 · 库尔森和我决定自己制备。我俩虽然没有经验,但可向我们实验室中的化学专家们请教,我们很乐于做这种与以前不同类型的工作。最后,我们成功地制备了所有四种核苷酸,方法是成功的。这是世界上第一次全部测出ΦX174的顺序。我们用单链余为模板,用从双链ΦX174中限制性内切酶切下的片段作为引物。从这里我们自然想到将这种方法用于其它更长的DMA顺序,但还存在两个主要问题,第一就是长期存在的分离问题,它始终在测序研究中起着重要作用,由于测序方法的速度越来越快,限制性、酶切片段作为引物的准备过程,就越来越成为重要的限速步骤,当时是用聚丙烯酰胺凝胶电泳作这种工作。纯化ΦX174只需走一次电泳即可,但纯化较大的DNA就成了问题。另一个困难就是这种方法需要单链DNA作为模板。这对于正常状态下就是单链的ΦX174是适用的,但大多数DNA通常是以双链形式存在的,此时制备单链DNA就可能很困难。我们用了不同的方法试着解决这个问题,发现最好的方法就是将需测序的DNA片段克隆进入单链噬菌体载体内,这不仅获得了单链DNA模板,而且也解决了分离的问题,克隆过程就是最好的纯化方法,并可适用于任何复杂的混合物,最有效的方法是由梅辛格(Messing)和他的同事发明的;现在已成为最快速的测定任何长度DNA顺序的方法。用的载体是单链噬菌体M13的双链形式,其中一段加工成了含有多种限制性内切酶切点的片段,可插入外源待测序的DNA片段。重组的混合物就会在细菌中扩增。这是基本的分离方法。每个噬菌斑都含有DNA片段的单个分子,因此是纯的。然后从中提取单链DNA;用作测序的模板,再用一段合成的互补于M13载体的寡核苷酸引物,结合在插入的DNA片段载体一侧,用DNA多聚酶在有ddNTP存在的情况下,合成插入片段的互补链。用这种方法,相同的纯化引物可大量合成制备,用于不同的重组体测序,这种方法是DNA链随机延伸过程。开始时,用限制性内切酶消化得到的外源DNA片段插入载体,但后来发现这是不必要的,现在通常用声波随机打断可得到较好的结果。
我想双脱氧测序法是我研究生涯的顶峰,而且是当我越来越陷入测序工作中不能自拔,并雄心壮志的实现。我非常兴奋并满意地在很多文章中读到这种方法正在许多实验室使用,不论是简单的,还是高级的生物基因组的大量顺序都在用这种方法测出。这对于弄清生命的基本问题很有益处。我想我从这个方法中得到的更大乐趣是看到方法的逐渐改进,直到我们能够直接从放射自显影胶片上读出DNA顺序。在可自动读顺序以前,人们常抱怨读顺序是乏味的事,但对我来说,它总是一件乐事,因为想到我们曾为了确定顺序中的一个碱基而呕心沥血地进行部分水解,分离及分析。有一段时期,我甚至把放射自显影胶片带回家中,期望着在静寂的夜晚读顺序时享受到的愉快。
与加减法产生的同时,马克斯艾姆(Maxam)和吉尔伯特发明了另一种快速测序技术。这与我们电泳后进行放射自显影读出DNA顺序的方法有些相像。当然,我们是通过DNA多聚酶的合成得到有相同末端碱基的不同长度的DNA链混合物,他们则是用化学法部分降解已在5'末端标上了同位素的片段。在当时,这比加减法更好,而且使用得更广泛。
在发明了M13克隆技术而大大增加了双脱氧方法的适用范围以前,马克斯艾姆和吉尔伯特的方法在美国甚至比双脱氧技术还得到广泛应用。我想,公正地说,目前对于较长顺序,双脱氧M13方法是最好的,而对于较短的特殊顺序,化学法可能较易操作。
当这两种技术在某种程度上可互补使用时,你一定对科学的进步感到欣喜。我对这种互补方法的并存却不能感到高兴。当然,这并不导致任何形式的激烈竞争,也完全没有影响到我们以后的工作。我并不满意加减法,而且双脱氧方法无疑也舍得到发展。但奇怪的足,为什么我没有发明出这种化学法。我确实有过相似的想法,但因怀疑它缺乏特异性而否决了,这可能是因为在蛋白质和DNA的工作中,常发现酶学方法比化学方法特异性强而较成功,因此,我对酶有偏爱,认为迅速降解测序的方法是有特异性的。事实上,马克斯艾姆和吉尔伯特的方法是非特昇的,但这没关系,甚至能得到比完全特异的反应更好的结果。
在这段解释中,我几乎完全描述了我们的测序方法,很少谈及所得到的结果。原因是文章篇幅有限,而且我个人主要是对方法学的贡献。在工作过程中,我们测定了很多顺序,并得到了很有意义的结果,这在其它地方已有报道,但我常是以小组中一个成员的身份作这些工作的。我很乐于做有点常规化的DNA测序工作,它可能不用花很大力气就能得到结果,我发现做这种工作可能较那种初期的,精确的,易变的,而且常常失败的,正在逐步改进的工作更舒服,至于长的DNA顺序,需要有人收集及分析数据,这个工作常由巴特 · 巴雷尔去作,他是测序奇才。一个例外就是当我们作λ噬菌体时,它主要由艾伦 · 库尔森和我测序,起初,收集资料的日常工作很有趣,但我想,我俩在最终完成测序工作时,才是最高兴的。
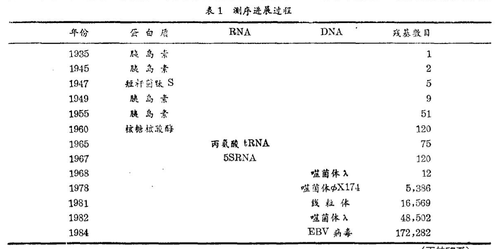
表1概述了顺序分析的进展过程,发展的不同阶段在本文中已讨论过了,从詹森等人1935年确定了胰岛素中第一个氨基酸开始,到最近DNA顺序研究的飞速发展止。目前,在资料库中DNA顺序的数目已达几百万,并仍以飞快的速度递增。
虽然本文只涉及到了测序方法的研究,但我的兴趣并不仅限于这方面,我不时地在其它领域里冒险,虽然这常是不成功的。最成功的就是发现了tRNA起始因子——甲酰甲硫氨酰tRNA。这主要是科耶德 · 马克(Kjeld,Marcker)的功劳,他作为访问学者在我们第一次试着解决RNA测序问题时来到我们实验室。当时想在与IRNA结合的氨基酸区域附近用标有放射活性的氨基酸测得顺序。部分水解就会得到不同长度的掺有氨基酸的寡核苷酸,再将它们测序。选择用甲硫氨酸试验这种方法,是因为用35S标记它可得到很高特异活性。看看连接有甲硫氨酸的tRNA是否工作,产物用胰核糖核酸酶消化后走电泳。就可测到预料之中的甲硫氨酸腺嘌呤酯,但还发现有另一个没预料到的点的出现,很易视作火为污染而被忽视,但马克不满足于这样的解释。经研究得出这是N - 甲酰甲硫氨酸腺嘌呤酯,再进行实验后,他指出在大肠杆菌中,有两种甲硫氨酰tRNA:—种是tRNAmMet它结合蛋白R链内的甲硫氨酸,另一种是tRNAfMet,它只结合肽链起始因子的氨基末端。
与很多科学家不同,我在65岁时决定退休并放弃研究工作。这使我的同事们非常惊奇,其实,在某种程度上对我也是如此。我一直没考虑过退休问题,直到我有一天突然想到再过几年,我就有65岁了,应该到了停止工作的时候,及做一些我总想做但以前从没有时间去做的事情。这种可能性对我似乎有巨大的吸引力,特别是当我们的DNA测序方法达到顶峰时,我确实感到再继续从事新的研究就会虎头蛇尾。我觉得我的决定是明智的,不仅是因为我非常喜爱新的生活方式,而且也是因为年岁不饶人,我已不能在实验室中再有上佳表现了,我觉得若我继续工作下去,就会发现总是失败,而且这样占着可给年轻人的位子是一种犯罪,四十多年来,我有幸有了极好的机会从事研究工作,而且得以实现我的梦想。